题目内容
5.ACV浓缩饮料曾风靡全美,当时美国《环球时报》也曾报道 ACV具有解毒、降脂、减肥和止泻等多种疗效.ACV浓缩饮料中,苹果酸M(相对分子质量为134)是主要的活性物质,其化学成分及相关信息如下:①含碳35.82%(质量分数,下同),含氢 4.51%,其余为氧元素;
②各取0.134g苹果酸M分别与足量NaHCO3反应放出CO2 44.8mL(标准状况,下同),与足量金属钠反应放出H2 33.6mL.
③M分子中所有碳原子在同一链线上,无支链.
请回答下列问题:
(1)M的化学式为C4H6O5,分子中含的官能团名称是羧基、羟基.
(2)为制备M,化学工作者从某气态烃与溴蒸气的取代产物分离出一种饱和的多溴代烃N,然后经多步反应,最后合生成M.合成路线为:N→有机物A→有机物B→有机物C→M其中B能发生银镜反应.则:
①有机物N的结构简式为BrCH2CH2CHBrCH2Br;
②有机物C转化为M的反应类型为加成(或还原)反应.
③A转化为B的化学方程式为2HOCH2CH2CHOHCH2OH+3O2$\stackrel{催化剂}{→}$2OHCCH2COCHO+6H2O.
(3)实验证明M分子间可形成多种具有水果香味的化合物,若其中某化合物分子中含有七元环,则其结构简式为
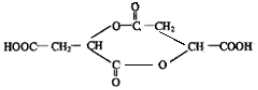 .
.(4)M有多种同分异构体,其中能同时满足下列条件的结构简式为
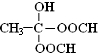 .(已知:
.(已知: )
)①1mol该有机物与足量金属钠反应生成0.5mol H2;
②经核磁共振检测,分子中含有3种不同环境的氢原子;
③1mol该有机物与足量NaOH溶液共热时,最多消耗3molNaOH,并生成两种钠盐.
分析 ①分子中C、H质量分数分别为w(C)=35.82%,w(H)=4.51%,则O的质量分数为:1-35.82%-4.51%=59.67%,又相对分子质量为134,所以该有机物则含C个数为:$\frac{134×35.83%}{12}$=4,含H个数为:$\frac{134×4.51%}{1}$=6,含O个数为:$\frac{134×59.67%}{16}$=5,则分子式为C4H6O5;
②各取0.134g即0.001mol苹果酸M分别与足量NaHCO3反应放出CO2 44.8mL即0.002mol(标准状况,下同),说明分子中含有2个-COOH,与足量金属钠反应放出H2 33.6mL即0.0015mol,说明分子中含有2个-COOH、1个-OH;
③M分子中所有碳原子在同一链线上,无支链,所以结构应为
化学工作者从某气态烃与溴蒸气的取代产物分离出一种饱和的多溴代烃N,然后经多步反应,最后合生成M.合成路线为:N→有机物A→有机物B→有机物C→M,其中B能发生银镜反应,说明B中含有醛基,又M为
解答 解:(1)根据以上分析,M的化学式为C4H6O5;分子中含的官能团名称是羧基和羟基,故答案为:C4H6O5;羧基;羟基;
(2)①根据以上分析,有机物N的结构简式为BrCH2CH2CHBrCH2Br,故答案为:BrCH2CH2CHBrCH2Br;
②C为HOOCCH2COCOOH,C加氢还原生成M,则反应类型为加成(或还原)反应,故答案为:加成(或还原)反应;
③A为HOCH2CH2CHOHCH2OH,A发生催化氧化生成B,化学方程式为2HOCH2CH2CHOHCH2OH+3O2$\stackrel{催化剂}{→}$2OHCCH2COCHO+6H2O,故答案为:2HOCH2CH2CHOHCH2OH+3O2$\stackrel{催化剂}{→}$2OHCCH2COCHO+6H2O;
(3)M为
 ,故答案为:
,故答案为: ;
;
(4)M为
③1mol该有机物与足量NaOH溶液共热时,最多消耗3molNaOH,并生成两种钠盐,又 ,所以符合条件的同分异构体同一个C原子上连有1个-OH与2个-OOCH,结构简式为
,所以符合条件的同分异构体同一个C原子上连有1个-OH与2个-OOCH,结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断,题目难度中等,注意根据题目要求计算相对分子质量,根据结构特点书写结构简式,把握同分异构体的书写方法.

| A. | 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 | |
| D. | 放电时正极附近溶液的碱性减弱 |
| A. | 铈(Ce)元素在自然界中主要以化合态形式存在 | |
| B. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI═CeI4+2H2↑ | |
| C. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+═Ce3++Fe3+ | |
| D. | 四种稳定的核素58136Ce、58138Ce、58140Ce、58142Ce,它们互称为同位素 |
| A. | 水、氧化铜和干冰都属于氧化物 | B. | H2SO4、HNO3、H2CO3都属于酸 | ||
| C. | 烧碱、纯碱(碳酸钠)、熟石灰都属于碱 | D. | NaHSO4、CuSO4和KMnO4都属于盐 |
| A. | Cl-浓度为0.2 mol/L | |
| B. | 取出10 mL溶液中Ba2+浓度为0.2 mol/L | |
| C. | 溶液中Cl-总数为0.2NA | |
| D. | 取出50 mL溶液中Ba2+和Cl-总数为0.03NA |
 2Fe + 3CO2可用于工业上炼铁,该反应属于
2Fe + 3CO2可用于工业上炼铁,该反应属于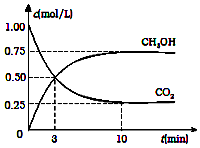 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示: