题目内容
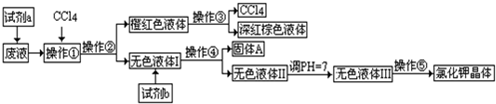
为了节能减排,提高综合经济效益,某工厂采用氨一硫酸铵治理含硫烟道气,同时吸收焦炉气中的氨,其工艺流程图如下:

(1)为提高原料利用率,在生产亚硫酸氢铵时,需加入少量对苯二酚,加入对苯二酚的目的是 .
(2)已知烟气含SO22%,焦炉气中含NH34.8%,若只生产硫酸铵一种产品,吸收后的尾气中所含的SO2或NH3可忽略),则含SO2烟气与焦炉气的流量(每分钟流过的体积)比为 .
(3)氨气吸收塔中发生反应的离子方程式为: .
(4)取一定量干燥的铵盐样品溶于水配成100mL溶液,向其中加入足量的氢氧化钡溶液,微热,产生4032mL(标准状况下)干燥的NH3,同时产生23.3g不溶于稀HNO3的白色沉淀,且该铵盐样品的水溶液不能使溴水褪色.则:原溶液中c(NH4+)= .原铵盐样品溶液不能使溴水褪色,说明该铵盐中不含 (填离子符号)原样品的成分及其物质的量是 .

(1)为提高原料利用率,在生产亚硫酸氢铵时,需加入少量对苯二酚,加入对苯二酚的目的是
(2)已知烟气含SO22%,焦炉气中含NH34.8%,若只生产硫酸铵一种产品,吸收后的尾气中所含的SO2或NH3可忽略),则含SO2烟气与焦炉气的流量(每分钟流过的体积)比为
(3)氨气吸收塔中发生反应的离子方程式为:
(4)取一定量干燥的铵盐样品溶于水配成100mL溶液,向其中加入足量的氢氧化钡溶液,微热,产生4032mL(标准状况下)干燥的NH3,同时产生23.3g不溶于稀HNO3的白色沉淀,且该铵盐样品的水溶液不能使溴水褪色.则:原溶液中c(NH4+)=
考点:氨的化学性质
专题:氮族元素
分析:(1)生产亚硫酸氢铵时,为防止亚硫酸铵氧化,应加入还原剂;
(2)根据质量守恒计算,即需要的NH3与SO2的物质的之比理论上应为2:1;
(3)氨气吸收塔中发生的反应为氨水和亚硫酸铵的反应;
(4)根据元素守恒确定离子的量计算浓度以及物质的量.
(2)根据质量守恒计算,即需要的NH3与SO2的物质的之比理论上应为2:1;
(3)氨气吸收塔中发生的反应为氨水和亚硫酸铵的反应;
(4)根据元素守恒确定离子的量计算浓度以及物质的量.
解答:
解:(1)生产亚硫酸氢铵时,为防止亚硫酸铵氧化,应加入还原剂,则生产亚硫酸氢铵时,为防止亚硫酸铵氧化,应加入还原剂,
故答案为:对苯二酚作还原荆,保证亚硫酸氧铵不被氧化;
(2)需要的NH3与SO2的物质的之比理论上应为2:1,设含SO2烟气与焦炉气的体积分别为x、y,
则有2%x:4.8%y=1:2,x:y=1.2:1,
故答案为:1.2:1.
(3)氨气吸收塔中发生的反应为氨水和亚硫酸铵的反应,反应的方程式为HSO3-+NH3?H2O=SO32-+NH4++H2O,
故答案为:HSO3-+NH3?H2O=SO32-+NH4++H2O;
(4)加入足量的氢氧化钡溶液,微热,产生4032mL即0.18mol(标准状况下)干燥的NH3,根据:NH4+~NH3,所以铵根离子的物质的量是0.18mol,原溶液中c(NH4+)=
=0.18mol/L,产生23.3g不溶于稀HNO3的白色沉淀,是硫酸钡沉淀,物质的量是0.1mol,根据硫酸根离子守恒,全部硫酸根离子是0.1moL,硫酸根离子和铵根离子的物质的量之比是0.1mol:0.18mol=5:9,成分组成是硫酸铵和硫酸氢铵,设二者的物质的量分别是x、y,则2x+y=0.18,x+y=0.1,解得x=0.08mol,y=0.02moL,故答案为:1.8mol/L;SO32-;(NH4)2SO4:0.08mol、NH4HSO4:0.02mol.
故答案为:对苯二酚作还原荆,保证亚硫酸氧铵不被氧化;
(2)需要的NH3与SO2的物质的之比理论上应为2:1,设含SO2烟气与焦炉气的体积分别为x、y,
则有2%x:4.8%y=1:2,x:y=1.2:1,
故答案为:1.2:1.
(3)氨气吸收塔中发生的反应为氨水和亚硫酸铵的反应,反应的方程式为HSO3-+NH3?H2O=SO32-+NH4++H2O,
故答案为:HSO3-+NH3?H2O=SO32-+NH4++H2O;
(4)加入足量的氢氧化钡溶液,微热,产生4032mL即0.18mol(标准状况下)干燥的NH3,根据:NH4+~NH3,所以铵根离子的物质的量是0.18mol,原溶液中c(NH4+)=
| 0.18mol |
| 0.1L |
点评:本题考查尾气的处理和实验流程问题,题目难度不大,本题注意把握物质的性质,解答本题一定要认真读题,加强自学能力的培养.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
称取两份铝粉,第一份加足量的氢氧化钠溶液,第二份加足量盐酸,如要放出等体积的气体(同温、同压下),两份铝粉的质量之比为( )
| A、1:2 | B、1:3 |
| C、3:2 | D、1:1 |
下列物质能导电的是( )
| A、冰醋酸 | B、乙醇 |
| C、乙酸溶液 | D、乙酸乙酯 |
一个原电池的总反应的离子方程式是:Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是( )
| 正极 | 负极 | 电解质溶液 | |
| A | Zn | Cu | CuCl2 |
| B | Zn | Cu | ZnCl2 |
| C | Cu | Zn | CuSO4 |
| D | Cu | Zn | ZnSO4 |
| A、A | B、B | C、C | D、D |
按如图装置进行实验(N装置中两个电极均为石墨棒),下列描述正确的是( )

| A、a、b未连接时,装置N中C1电极上有气体析出 |
| B、不论a、b是否连接,装置M中观察到的实验现象相同 |
| C、a、b连接,工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小 |
| D、a、b连接,装置M中若有0.1molSO42-移到Cu电极,装置N中C2极放出H22.24L(标准状况) |
下列物质中只有离子键的是( )
| A、O2 |
| B、NaOH |
| C、H2O |
| D、NaCl |
 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如下图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如下图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁. 和
和 ;③氧气(O2)与臭氧(O3);④D与T;
;③氧气(O2)与臭氧(O3);④D与T;
