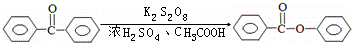题目内容
6.已知(1)C(s)+O2(g)=CO2(g)△H1=-393kJ/mol(2)2C(s)+O2(g)=2CO(g)△H2=-221kJ/mol
(3)2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ/mol
求C(s)+CO2(g)=2CO(g)△H4=+172.67kJ/mol(写出解题过程,注意格式)
分析 根据盖斯定律热化学方程式乘以合适的系数进行加减,反应热也乘以相应的系数进行相应的加减,构造目标热化学方程式.据此计算.
解答 解:(1)C(s)+O2(g)=CO2(g)△H1=-393kJ/mol
(2)2C(s)+O2(g)=2CO(g)△H2=-221kJ/mol
(3)2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ/mol,
根据盖斯定律,[(1)+(2)-(3)×2]×$\frac{1}{3}$得C(s)+CO2(g)=2CO(g)△H4=[(△H1+△H2-△H3×2]×$\frac{1}{3}$,所以△H4=[(△H1+△H2-△H3×2]×$\frac{1}{3}$=[(-393kJ/mol+(-221kJ/mol)-(-566.0kJ/mol)×2]×$\frac{1}{3}$≈+172.67kJ/mol,
故答案为:+172.67kJ/mol.
点评 本题考查盖斯定律、反应热计算等,题目难度不大,根据盖斯定律构造目标热化学方程式是关键.

练习册系列答案
相关题目
14.下列化学用语表达正确的是( )
| A. | Cl-离子的结构示意图: | |
| B. | 水分子的电子式: | |
| C. | 乙醇的结构简式:C2H6O | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
1.下列离子方程式书写正确的是( )
| A. | 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | NaOH溶液中通入少量SO2:2OH-+SO2═SO32-+H2O |
11.在①甲烷、②乙烯、③苯、④甲苯四种有机物化合物,分子内所有原子均在同一平面的是( )
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
18.将22克CH4和C2H4的混合气体通入盛有足量溴水的容器中,气体的质量减少了14克,则混合气体中CH4和C2H4的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 2:3 |
16.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 8.8g乙酸乙酯中含共用电子对数为1.4 NA | |
| C. | 1 L 0.1 mol•L-1氯化铜溶液中铜离子数为0.1 NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
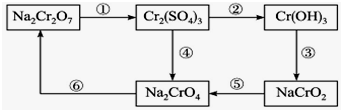 铬是水体的主要的污染物之一,可以导致水生生物死亡.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质.例如处理铬的实验循环示意图如图:
铬是水体的主要的污染物之一,可以导致水生生物死亡.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质.例如处理铬的实验循环示意图如图: 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.