题目内容
3.现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )| A. | 最高正化合价:③>②>① | B. | 单质氧化性:③>①>② | ||
| C. | 电负性:③>②>① | D. | 原子半径:③>②>① |
分析 由核外电子排布式可知:①[Ne]3s23p4为S元素,②1s22s22p63s23p3为P元素,③1s22s22p5为F元素;
A、最高正化合价等于最外层电子数,注意F、O元素一般没有正化合价;
B、元素的非金属性越强对应单质的氧化性越强;
C、同周期自左而右,电负性增大,同主族自上而下降低;
D、同周期自左而右,原子半径减小,同主族自上而下原子半径增大;
解答 解:由核外电子排布式可知:①[Ne]3s23p4为S元素,②1s22s22p63s23p3为P元素,③1s22s22p5为F元素;
A、S元素最高正化合价为+6,P元素最高正化合价为+5,F没有正化合价,故最高正化合价:①>②,故A错误;
B、元素的非金属性:F>S>P,所以对应单质的氧化性越强:③>①>②,故B正确;
C、同周期自左而右,电负性增大,同主族自上而下降低,故电负性③>①>②,故C错误;
D、同周期自左而右,原子半径减小,同主族自上而下原子半径增大,故原子半径P>S>F,即②>①>③,故D错误;
故选B.
点评 本题考查核外电子排布规律、元素周期律等,难度不大,注意能级处于半满、全满时元素的第一电离能高于同周期相邻元素.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13. 如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )
如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )
 如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )
如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )| A. | 紫、红、蓝 | B. | 红、蓝、紫 | C. | 红、紫、蓝 | D. | 蓝、紫、红 |
11. 在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )
在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )
 在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )
在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )| A. | “彩雾”是一种混合物 | |
| B. | 上述过程中有物理变化 | |
| C. | 燃料燃烧产生的热量促使拉烟剂气化 | |
| D. | “彩雾”的形成与焰色反应的原理相同 |
18.第31届夏季奥林匹克运动会,又称2016年里约热内卢奥运会,将于2016年8月5日-21日在巴西的里约热内卢 举行.奥运会期间,志愿者使用的快餐盒内层是用铝箔包裹并已加工好的真空包装食品,外层则是分别包装的两包化学物质,吃饭前拉动预留在外的拉线使这两种化学物质接触反应,放出的热量便可对食物进行加热,最适合做这两包化学物质的( )
| A. | 生石灰和水 | B. | 熟石灰和水 | C. | 浓硫酸和水 | D. | 氯化钠和水 |
8.关于目前常用元素周期表的说法中正确的是( )
| A. | 第ⅢB族元素种类最多 | |
| B. | 只有第3列到第12列全部是金属元素 | |
| C. | 周期数大于或等于族的序数时,一定是金属元素 | |
| D. | 是按原子的质量数由小到大的顺序编制的 |
15.某元素的一个原子核内质子数为m,中子数为n,则下列说法正确的是( )
| A. | 该元素的相对原子质量的近似值一定是(m+n) | |
| B. | 不能由此确定该元素的相对原子质量 | |
| C. | 若12C的质量为Wg,则该原子的质量约为(m+n)Wg | |
| D. | 若NA表示阿伏加德罗常数,则该原子的摩尔质量为(m+n)•NA |
12.氧化性最弱的微粒是( )
| A. | Cl2 | B. | Na+ | C. | Cu2+ | D. | Mg2+ |
14.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为120° |
| C | H2O的沸点大于H2S的沸点 | H2O是液态的,H2S是气态的 |
| D | HF比HCl稳定 | HF分子间可以形成氢键 |
| A. | A | B. | B | C. | C | D. | D |
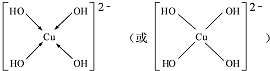 .(用→标出配位键)1mol[Cu (OH)4]2-中有8mol σ键.
.(用→标出配位键)1mol[Cu (OH)4]2-中有8mol σ键.