题目内容
12.向50mLH2O2水溶液中加入2g二氧化锰粉末,放出标准状况下气体的体积与时间的关系如图1所示: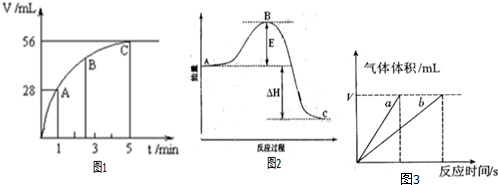
(1)写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:

为了加快过氧化氢分解的速率,还可以用某些无机试剂代替二氧化锰作为催化剂,试写出两种催化剂的名称氯化铁、硫酸铜.
(2)图中A、B、C各点所表示的反应速率由小到大的顺序为C<B<A,产生这种变化的原因是随着反应的进行,反应物浓度减小,因此反应速率逐渐减小.
(3)起始时,H2O2水溶液的物质的量浓度为0.1mol•L-1;5分钟内,用H2O2表示H2O2分解的反应速率为0.02mol/(L•min).
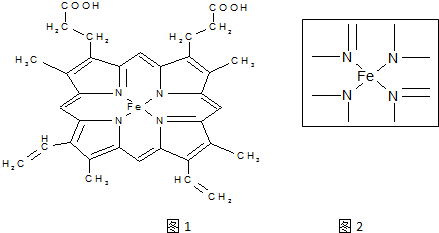
(4)如图2是H2O2在没有催化剂的情况下的反应进程与能量变化图.
?请在图中画出使用催化剂时的反应进程与能量变化图.
?图中A表示反应物的总能量,C表示生成物的总能量,E的大小对该反应的反应热△H有无影响?无.
?图3中,a曲线是二氧化锰存在时过氧化氢分解的曲线(填“a”或“b”).
分析 (1)双氧水在催化剂的作用下分解产生水和氧气;氯化铁和硫酸铜对双氧水的催化效果明显;
(2)根据斜率大小得出三点速率的大小,根据浓度对反应速率的影响分析;
(3)由图可知,生成氧气为56mL,n(O2)=$\frac{0.056L}{22.4L•mo{l}^{-1}}$=0.0025mol,则n(H2O2)=0.0025mol×2=0.005mol,结合c=$\frac{n}{V}$计算;5分钟的速率由v=$\frac{△c}{△t}$计算;
(4)双氧水的分解是一个放热反应,A表示反应物具有的总能量高,C表示生成物具有的总能量低,催化剂可以降低反应的活化能,但是不影响反应物和生成物的总能量,不影响反应热△H,如图虚线所示是有催化剂时的曲线(虚线代表使用催化剂,起、终点重合),催化剂只加快反应速率,缩短达到平衡所需的时间,不影响氢气的总量,曲线a为有催化剂的曲线.
解答 解:(1)双氧水在催化剂的作用下分解产生水和氧气,用单线桥表示电子转移为: ;双氧水分解反应中还可以用氯化铁或者硫酸铜代替二氧化锰做催化剂加快反应速率,
;双氧水分解反应中还可以用氯化铁或者硫酸铜代替二氧化锰做催化剂加快反应速率,
故答案为: ;氯化铁;硫酸铜;
;氯化铁;硫酸铜;
(2)曲线表示斜率越大,反应速率越快,A、B、C各点所表示的反应速率由小到大的顺序为C<B<A,这是由于随着反应的进行,反应物浓度减小,因此反应速率逐渐减小,
故答案为:C<B<A;随着反应的进行,反应物浓度减小,因此反应速率逐渐减小;
(3)根据图象可知H2O2完全分解后生成氧气的物质的量是n(O2)=$\frac{0.056L}{22.4L•mo{l}^{-1}}$=0.0025mol,则根据方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑可知双氧水的物质的量是0.005mol,所以该H2O2水溶液的物质的量浓度为0.005mol÷0.05L=0.1mol•L-1,反应速率为v=$\frac{△c}{△t}$=$\frac{0.1mol•{L}^{-1}}{5min}$=0.02mol/(L•min),
故答案为:0.1mol•L-1;0.02mol/(L•min);
(4)双氧水的分解是一个放热反应,A表示反应物具有的总能量高,C表示生成物具有的总能量低,催化剂可以降低反应的活化能,但是不影响反应物和生成物的总能量,不影响反应热△H,如图虚线所示是有催化剂时的曲线(虚线代表使用催化剂,起、终点重合)
催化剂只加快反应速率,缩短达到平衡所需的时间,不影响氢气的总量,曲线a为有催化剂的曲线,
故答案为: ;反应物的总能量;生成物的总能量;无;a.
;反应物的总能量;生成物的总能量;无;a.
点评 考查过氧化氢分解实验的有关判断和计算、电子转移的表示方法、化学反应与能量的知识,注意图象中斜率与反应速率的关系,注重基础知识的考查,题目难度不大.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | c(H+)>c(SO42-)>c(NH4+) | |
| B. | c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) | |
| D. | 室温下滴加NaOH溶液至溶液呈中性后:c(Na+)>c(SO42-)>c(OH-)=c(H+) |
| A. | 在温度不变时,水溶液中c(H+)和c(0H-)不能同时增大 | |
| B. | pH=3的盐酸和pH=5的硫酸等体积混合,pH=4 | |
| C. | 中性溶液中必然有c(H+)=c(0H-)=1×10-7mol/L | |
| D. | 在0.1mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
③试分析该实验中难以控制的实验条件是什么?锌粒的表面积完全相同.
| A. | 加入氯水振荡,观察水层是否有棕红色出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
| A. | 离子半径:Na+>Mg2+>Al3+>F- | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性强弱:H2SO4>H2CO3>H2SiO3 |
| A. | Fe2O3常用于制造红色油漆和涂料 | B. | 水玻璃可用作木材的防火剂 | ||
| C. | 铝制容器可用于盛装稀硫酸 | D. | 碘化银可用于人工降雨 |
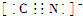 ,1mol O22+中含有的π键数目为2NA.
,1mol O22+中含有的π键数目为2NA.
 $→_{△}^{NaOH_{2}醇}$D$\stackrel{H+}{→}$E$→_{浓H_{2}SO_{4}}^{CH_{3}OH}$CH3OOC-CH=CH-COOCH3,则B物质应为下列哪种物质( )
$→_{△}^{NaOH_{2}醇}$D$\stackrel{H+}{→}$E$→_{浓H_{2}SO_{4}}^{CH_{3}OH}$CH3OOC-CH=CH-COOCH3,则B物质应为下列哪种物质( )


