题目内容
18.下列说法正确的是( )| A. | 在温度不变时,水溶液中c(H+)和c(0H-)不能同时增大 | |
| B. | pH=3的盐酸和pH=5的硫酸等体积混合,pH=4 | |
| C. | 中性溶液中必然有c(H+)=c(0H-)=1×10-7mol/L | |
| D. | 在0.1mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
分析 A.在温度不变时,水溶液中c(H+)×c(0H-)为定值;
B.酸溶液混合,先计算混合后溶液中氢离子的物质的量,再根据c=$\frac{n}{V}$计算氢离子的物质的量浓度,最后根据pH=-lgc(H+)计算出混合液的pH;
C.常温下,中性溶液中c(H+)=c(0H-)=1×10-7mol/L;
D.溶液中c(H+)×c(0H-)为定值.
解答 解:A.在温度不变时,水溶液中c(H+)×c(0H-)为定值,所以c(H+)和c(0H-)不能同时增大,故A正确;
B.pH=3的盐酸和pH=5的硫酸等体积混合后,设体积均为VL,混合液中氢离子的物质的量为:n(H+)=VL×10-3mol/L+VL×10-5mol/L≈10-3Vmol,
则混合溶液中氢离子浓度为:c(H+)=$\frac{1{0}^{-3}mol}{2VL}$=5×10-4mol/L,所以pH=-lg5×10-4=4-lg5=3.3,故B错误;
C.常温下,中性溶液中c(H+)=c(0H-)=1×10-7mol/L,温度不知道,所以c(H+)和c(0H-)不一定等于1×10-7mol/L,故C错误;
D.在0.1mol/L HCl溶液中加入适量的蒸馏水,c(H+)减小,由于溶液中c(H+)×c(0H-)为定值,所以c(0H-)增大,故D错误.
故选A.
点评 本题考查了混合液的pH的计算、影响水的电离平衡的因素,题目难度不大,注意掌握pH的表达式及计算方法,明确溶液酸碱性与溶液pH的关系为解答关键,试题有利于培养学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.常温下,下列金属制成的容器能盛放浓硝酸的是( )
| A. | 铝 | B. | 镁 | C. | 铜 | D. | 银 |
9.在Na2CO3溶液中,有关离子浓度的关系正确的是( )
| A. | c(Na+)=2c(CO32-) | B. | c(H+)>c(OH-) | C. | c(CO32-)>c(HCO3-) | D. | c(CO32-)>c(OH-) |
6.下列关于皂化反应的说法中.错误的是( )
| A. | 油脂经皂化反应后,生成高级脂肪酸钠,甘油和水形成混合液 | |
| B. | 加入食盐可以使肥皂析出,这一过程叫盐析 | |
| C. | 加入食盐搅拌后,静置一段时间,溶液分成上下两层,下层是高级脂肪酸钠 | |
| D. | 皂化反应后的混合溶液中加入食盐,可以通过过滤的方法分离提纯 |
13.下列有关实验原理或操作叙述正确的是( )
| A. | 用干燥洁净的玻璃棒蘸取NaClO溶液,滴到表面皿上的pH试纸上测pH | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 取金属钠时,要先用镊子夹取,再用小刀切下所需量,剩余钠不能放回原试剂瓶中 | |
| D. | 用NaOH标准溶液滴定盐酸,滴定管尖嘴部分若在滴定前无气泡,滴定终点时出现气泡,测定结果将偏大 |
5. 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
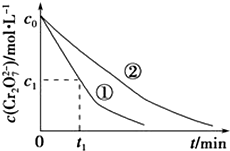
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示.
(2)上述反应后草酸被氧化的离子方程式为Cr2O72-+3H2C2O4+8H+=6CO2↑+2Cr3++7H2O
(3)实验①和②的结果表明溶液PH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
(2)上述反应后草酸被氧化的离子方程式为Cr2O72-+3H2C2O4+8H+=6CO2↑+2Cr3++7H2O
(3)实验①和②的结果表明溶液PH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立 |
9.下列过程不是原电池工作原理的是( )
| A. | 析氢腐蚀 | B. | 牺牲阳极的阴极保护法 | ||
| C. | 吸氧腐蚀 | D. | 外加电流的阴极保护法 |
10.既能跟盐酸又能跟氢氧化钠溶液反应的物质是( )
| A. | MgO | B. | Al(OH)3 | C. | HNO3 | D. | CaCO3 |