题目内容
向Ba(OH)2溶液中加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式: .
(2)下列三种情况下,离子方程式与(1)相同的是 .
A.A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量.
(1)写出反应的离子方程式:
(2)下列三种情况下,离子方程式与(1)相同的是
A.A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量.
考点:离子方程式的书写
专题:离子反应专题
分析:(1)所有离子都参加离子反应,相关离子要符合组成之比;
(2)A.溶液显中性,氢离子的浓度等于氢氧根离子的浓度.
B.SO42-恰好完全沉淀,Ba2+和SO42-的量相等;
C.逐滴加入Ba(OH)2溶液至过量,NaHSO4溶液少量,少的要符合组成之比.
(2)A.溶液显中性,氢离子的浓度等于氢氧根离子的浓度.
B.SO42-恰好完全沉淀,Ba2+和SO42-的量相等;
C.逐滴加入Ba(OH)2溶液至过量,NaHSO4溶液少量,少的要符合组成之比.
解答:
解:(1)所有离子都参加离子反应,相关离子要符合组成之比,故离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
(2)A.溶液显中性,氢离子的浓度等于氢氧根离子的浓度,故离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
B.SO42-恰好完全沉淀,Ba2+和SO42-的量相等,故离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O;
C.逐滴加入Ba(OH)2溶液至过量,NaHSO4溶液少量,少的要符合组成之比,故离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O,故选A.
(2)A.溶液显中性,氢离子的浓度等于氢氧根离子的浓度,故离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
B.SO42-恰好完全沉淀,Ba2+和SO42-的量相等,故离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O;
C.逐滴加入Ba(OH)2溶液至过量,NaHSO4溶液少量,少的要符合组成之比,故离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O,故选A.
点评:本题考查离子方程式的书写,学生要把握离子方程书写的一般规律,就可以解题,比较容易.

练习册系列答案
相关题目
有关氨气的实验较多,下面对这些实验的实验原理的分析中,错误的是( )
| A、氨气极易溶解于水的性质可以解释氨气的喷泉实验 |
| B、氨气的还原性可以解释氨气与氯化氢的反应实验 |
| C、铵盐与碱反应可得到氨气是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因 |
| D、NH3?H2O的热不稳定性可以解释实验室中用加热氨水的方法制取氨气 |
下列物质中,其主要成分不是硅酸盐的是( )
| A、石英玻璃 | B、陶瓷 |
| C、普通玻璃 | D、高岭土 |
已知M、W、X、Y、Z为短周期元素,M为形成化合物最多的元素,W、Z同主族,X、Y、Z同周期,Z元素的原子序数为W的2倍,Z的最外层电子数为Y的最外层电子数的2倍,W和X能形成X2W和X2W2两种化合物,下列说法不正确的是( )
| A、W、X、Y形成的简单离子,其半径大小关系为Y>W>X |
| B、M、W元素形成的简单氢化物的稳定性:W>M |
| C、X金属元素是同周期中金属性最强的元素 |
| D、Z的最高价氧化物对应的水化物的浓溶液能与Y在常温下剧烈反应 |
设NA为阿伏加德罗常数的值,下列说法正确的组合是( )
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA
d 常温下,1mol?L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 标准状况下,2.24L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol?L-1 AlCl3溶液中阳离子总数大于0.1NA.
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA
d 常温下,1mol?L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 标准状况下,2.24L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol?L-1 AlCl3溶液中阳离子总数大于0.1NA.
| A、a c f h |
| B、a c e g |
| C、a c e f h |
| D、b d e h |
下列叙述正确的是( )
A、S2-的结构示意图是 |
B、HCl的电子式为 |
C、NH3的结构式为 |
| D、还原性:HCl>H2S |
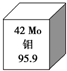 我国安徽发现了全国最大的钼矿,如图是钼元素的相关信息,下列有关钼的说法错误的是( )
我国安徽发现了全国最大的钼矿,如图是钼元素的相关信息,下列有关钼的说法错误的是( )| A、95Mo原子核内有53个中子 |
| B、95Mo原子核外有42个电子 |
| C、92Mo、95Mo、98Mo互为同位素 |
| D、92Mo、95Mo、98Mo的化学性质有较大的不同 |
核电荷数为1~20的元素中,次外层电子数是最外电子层电子数4倍的元素共有( )
| A、4种 | B、3种 | C、2种 | D、1种 |