题目内容
下列离子方程式中,属于水解反应的是( )
| A、CH3COOH+H2O?CH3COO-+H3O+ |
| B、CO2+H2O?HCO3-+H+ |
| C、HCO3-+H2O?H2CO3+OH- |
| D、HS-+H2O?S2-+H3O+ |
考点:盐类水解的原理
专题:盐类的水解专题
分析:水解反应为弱酸或弱碱离子结合生成水电离的氢离子或氢氧根离子生成弱电解质的反应,以此来解答.
解答:
解:A、CH3COOH+H2O?CH3COO-+H3O+是醋酸的电离方程式,故A错误;
B、CO2+H2O?HCO3-+H+是二氧化碳和水之间反应生成碳酸,达到平衡,碳酸的第一步电离方程式,故B错误;
C、HCO3-+H2O?H2CO3+OH-为碳酸氢根离子的水解反应,遵循电荷守恒,故C正确;
D、HS-+H2O?S2-+H3O+是硫氢根离子的电离方程式,故D错误.
故选C.
B、CO2+H2O?HCO3-+H+是二氧化碳和水之间反应生成碳酸,达到平衡,碳酸的第一步电离方程式,故B错误;
C、HCO3-+H2O?H2CO3+OH-为碳酸氢根离子的水解反应,遵循电荷守恒,故C正确;
D、HS-+H2O?S2-+H3O+是硫氢根离子的电离方程式,故D错误.
故选C.
点评:本题考查离子反应方程式的书写,明确水解与电离的区别是解答本题的关键,注意选项B为解答的易错点,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、可逆反应的正、逆反应的反应热相等,即△H(正)=△H(逆) |
| B、平衡时,增加某反应物的物质的量,则平衡一定向正反应方向移动 |
| C、相同条件下,同一可逆反应使用不同催化剂可达到不同的平衡状态 |
| D、在一定条件下,可逆反应的正、逆反应速率相等时,达到化学平衡 |
有关氨气的实验较多,下面对这些实验的实验原理的分析中,错误的是( )
| A、氨气极易溶解于水的性质可以解释氨气的喷泉实验 |
| B、氨气的还原性可以解释氨气与氯化氢的反应实验 |
| C、铵盐与碱反应可得到氨气是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因 |
| D、NH3?H2O的热不稳定性可以解释实验室中用加热氨水的方法制取氨气 |
下列实验现象中,由于发生取代反应而引起的是( )
| A、将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生 |
| B、乙烯通入溴的四氯化碳溶液中,溶液褪色 |
| C、苯滴加到溴水中,振荡后水层接近无色 |
| D、甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着 |
下列化学用语正确的是( )
| A、丙烯的结构简式:CH2CHCH3 |
B、次氯酸的电子式  |
C、CH4分子的比例模型: |
D、Cl-的结构示意图 |
下列反应一定有沉淀生成的是( )
| A、将SO2通入BaCl2溶液中 |
| B、将NH3通入AgNO3溶液中 |
| C、将Cl2通入AgNO3溶液中 |
| D、将NO2通入Ca(OH)2溶液中 |
下列物质中,其主要成分不是硅酸盐的是( )
| A、石英玻璃 | B、陶瓷 |
| C、普通玻璃 | D、高岭土 |
已知M、W、X、Y、Z为短周期元素,M为形成化合物最多的元素,W、Z同主族,X、Y、Z同周期,Z元素的原子序数为W的2倍,Z的最外层电子数为Y的最外层电子数的2倍,W和X能形成X2W和X2W2两种化合物,下列说法不正确的是( )
| A、W、X、Y形成的简单离子,其半径大小关系为Y>W>X |
| B、M、W元素形成的简单氢化物的稳定性:W>M |
| C、X金属元素是同周期中金属性最强的元素 |
| D、Z的最高价氧化物对应的水化物的浓溶液能与Y在常温下剧烈反应 |
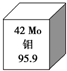 我国安徽发现了全国最大的钼矿,如图是钼元素的相关信息,下列有关钼的说法错误的是( )
我国安徽发现了全国最大的钼矿,如图是钼元素的相关信息,下列有关钼的说法错误的是( )| A、95Mo原子核内有53个中子 |
| B、95Mo原子核外有42个电子 |
| C、92Mo、95Mo、98Mo互为同位素 |
| D、92Mo、95Mo、98Mo的化学性质有较大的不同 |