题目内容
 (Ⅰ)已知:H+(aq)+OH-(aq)═H2O(l)△H1=-57.3kJ/mol
(Ⅰ)已知:H+(aq)+OH-(aq)═H2O(l)△H1=-57.3kJ/molCH3COOH(aq)?H+(aq)+CH3COO-(aq)△H2=+1.3kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式:
(Ⅱ)已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-═2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-═2H2O+I2的反应速率.
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 |
H2O | 0.01 mol?L-1 X 溶液 |
0.1 mol?L-1 双氧水 |
1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(2)实验1、3的目的是
(3)实验1,浓度c(X)~t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~t的变化曲线图(进行相应的标注).
(4)已知,I2与X反应时,两者物质的量之比为1:2.按上面表格中的X和KI的加入量,加入V(H2O2)>
考点:探究影响化学反应速率的因素,测定某些化学反应的速率
专题:实验设计题,化学反应速率专题
分析:Ⅰ利用盖斯定律计算反应热;
Ⅱ(1)根据实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响判断m、n;
(2)对比实验1、3可以看出,两组实验只有KI的浓度不一样,其它条件都一样,最后测出反应时间不一样,所以实验1、3的目的是探究KI浓度对H2O2+2H++2I-=2H2O+I2反应速率的影响;对比实验1、4可以看出,实验4比实验1多了催化剂,其它条件都一样,最后测出反应时间不一样,所以实验1、4的目的是探究催化剂对H2O2+2H++2I-=2H2O+I2反应速率的影响,据此答题;
(3)根据表格可以看出,实验3与实验1相比,KI的起始浓度小,反应时间变长,实验4与实验1相比,浓度都一样,实验4用了催化剂,反应时间变短,据此可以画图;
(4)根据上述表格可知X的物质的量为0.01 mol?L-1×0.01L=1.0×10-4mol,所以I2的物质的量为5.0×10-5mol?,根据化学方程式H2O2+2H++2I-═2H2O+I2可求得需要H2O2的物质的量为5.0×10-5mol,据此求得双氧水的体积;先计算v(x)速率,再根据速率之间关系得出v(I-)速率.
Ⅱ(1)根据实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响判断m、n;
(2)对比实验1、3可以看出,两组实验只有KI的浓度不一样,其它条件都一样,最后测出反应时间不一样,所以实验1、3的目的是探究KI浓度对H2O2+2H++2I-=2H2O+I2反应速率的影响;对比实验1、4可以看出,实验4比实验1多了催化剂,其它条件都一样,最后测出反应时间不一样,所以实验1、4的目的是探究催化剂对H2O2+2H++2I-=2H2O+I2反应速率的影响,据此答题;
(3)根据表格可以看出,实验3与实验1相比,KI的起始浓度小,反应时间变长,实验4与实验1相比,浓度都一样,实验4用了催化剂,反应时间变短,据此可以画图;
(4)根据上述表格可知X的物质的量为0.01 mol?L-1×0.01L=1.0×10-4mol,所以I2的物质的量为5.0×10-5mol?,根据化学方程式H2O2+2H++2I-═2H2O+I2可求得需要H2O2的物质的量为5.0×10-5mol,据此求得双氧水的体积;先计算v(x)速率,再根据速率之间关系得出v(I-)速率.
解答:
解;Ⅰ已知:①H+(aq)+OH-(aq)=H2O(l)△H1=-57.3kJ/mol
②CH3COOH(aq)?H+(aq)+CH3COO-(aq)△H2=+1.3kJ/mol
则利用盖斯定律将①+②可得CH3COOH(aq)+OH-(aq)=H2O(l)+CH3COO-(aq)△H=-56.0kJ/mol,
故答案为:CH3COOH(aq)+OH-(aq)=H2O(l)+CH3COO-(aq)△H=-56.0kJ/mol;
Ⅱ(1)由于实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响,所以除了双氧水的浓度不同外,气体其它条件完全相同,所以m=20.0,n=20.0,
故答案为:20.0;20.0;
(2)对比实验1、3可以看出,两组实验只有KI的浓度不一样,其它条件都一样,最后测出反应时间不一样,所以实验1、3的目的是探究KI浓度对H2O2+2H++2I-=2H2O+I2反应速率的影响;对比实验1、4可以看出,实验4比实验1多了催化剂,其它条件都一样,最后测出反应时间不一样,所以实验1、4的目的是探究催化剂对H2O2+2H++2I-=2H2O+I2反应速率的影响,
故答案为:探究KI浓度对H2O2+2H++2I-=2H2O+I2反应速率的影响;探究催化剂对H2O2+2H++2I-=2H2O+I2反应速率的影响;
(3)根据表格可以看出,实验3与实验1相比,KI的起始浓度小,反应时间变长,实验4与实验1相比,浓度都一样,实验4用了催化剂,反应时间变短,据此可以画图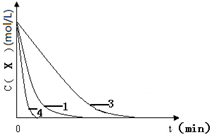 故答案为:
故答案为: ;
;
(4)根据上述表格可知X的物质的量为0.01 mol?L-1×0.01L=1.0×10-4mol,所以I2的物质的量为5.0×10-5mol,根据化学方程式H2O2+2H++2I-═2H2O+I2可求得需要H2O2的物质的量为5.0×10-5mol,据此求得双氧水的体积为
=0.5ml;
v(X)=
=4.5×10-4mol/(L?min)
2I-→I2 1molI2消耗2molX,所以v(I-)=v(X)=4.5×10-4mol/(L?min);
故答案为:0.5; 4.5×10-4mol/(L?min).
②CH3COOH(aq)?H+(aq)+CH3COO-(aq)△H2=+1.3kJ/mol
则利用盖斯定律将①+②可得CH3COOH(aq)+OH-(aq)=H2O(l)+CH3COO-(aq)△H=-56.0kJ/mol,
故答案为:CH3COOH(aq)+OH-(aq)=H2O(l)+CH3COO-(aq)△H=-56.0kJ/mol;
Ⅱ(1)由于实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响,所以除了双氧水的浓度不同外,气体其它条件完全相同,所以m=20.0,n=20.0,
故答案为:20.0;20.0;
(2)对比实验1、3可以看出,两组实验只有KI的浓度不一样,其它条件都一样,最后测出反应时间不一样,所以实验1、3的目的是探究KI浓度对H2O2+2H++2I-=2H2O+I2反应速率的影响;对比实验1、4可以看出,实验4比实验1多了催化剂,其它条件都一样,最后测出反应时间不一样,所以实验1、4的目的是探究催化剂对H2O2+2H++2I-=2H2O+I2反应速率的影响,
故答案为:探究KI浓度对H2O2+2H++2I-=2H2O+I2反应速率的影响;探究催化剂对H2O2+2H++2I-=2H2O+I2反应速率的影响;
(3)根据表格可以看出,实验3与实验1相比,KI的起始浓度小,反应时间变长,实验4与实验1相比,浓度都一样,实验4用了催化剂,反应时间变短,据此可以画图
 故答案为:
故答案为: ;
;(4)根据上述表格可知X的物质的量为0.01 mol?L-1×0.01L=1.0×10-4mol,所以I2的物质的量为5.0×10-5mol,根据化学方程式H2O2+2H++2I-═2H2O+I2可求得需要H2O2的物质的量为5.0×10-5mol,据此求得双氧水的体积为
| 5.0×10-5mol |
| 0.1 mol?L-1 |
v(X)=
| 0.01mol/L×0.01L |
| 0.08L×2.8min |
2I-→I2 1molI2消耗2molX,所以v(I-)=v(X)=4.5×10-4mol/(L?min);
故答案为:0.5; 4.5×10-4mol/(L?min).
点评:本题主要考查了盖斯定律、浓度和催化剂对化学反应速率的影响,中等难度,解题时要注意对题中的信息时行加工处理,对能力考查有一定的要求.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
物质发生化学变化时:①电子总数②原子总数③分子总数④物质的种类⑤物质的总质量⑥物质的总能量⑦原子种类,反应前后肯定不发生变化的是( )
| A、①②③⑤ | B、①②⑤⑦ |
| C、②⑤⑥ | D、①④⑤⑥ |
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最少的是( )
| A、Al |
| B、Al(OH)3 |
| C、AlCl3 |
| D、Al2O3 |
下列离子方程式正确的是( )
| A、HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | ||||
B、用铜为电极电解饱和食盐水:2Cl-+2H2O
| ||||
| C、用白醋除铁锈:Fe2O3+6H+═3H2O+2Fe3+ | ||||
| D、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |








 如图有机物A的分子,所含有的官能团的名称是
如图有机物A的分子,所含有的官能团的名称是