题目内容
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最少的是( )
| A、Al |
| B、Al(OH)3 |
| C、AlCl3 |
| D、Al2O3 |
考点:化学方程式的有关计算,镁、铝的重要化合物
专题:计算题,几种重要的金属及其化合物
分析:A.铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
B.氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O;
C.AlCl3与氢氧化钠反应为AlCl3+4NaOH=NaAlO2+3NaCl+2H2O;
D.Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+H2O,
令各物质的质量分别为1g,根据方程式计算消耗氢氧化铝的质量,据此判断.
B.氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O;
C.AlCl3与氢氧化钠反应为AlCl3+4NaOH=NaAlO2+3NaCl+2H2O;
D.Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+H2O,
令各物质的质量分别为1g,根据方程式计算消耗氢氧化铝的质量,据此判断.
解答:
解:令各物质的质量分别为1g,
A.铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1gAl消耗NaOH质量=
=1.48g;
B.氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O,1g氢氧化铝消耗氢氧化钠质量=
=0.51g;
C.AlCl3与氢氧化钠反应为AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,1g氯化铝消耗氢氧化钠质量=
=1.12g;
D.Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+H2O,1g氧化铝消耗氢氧化钠的质量=
=0.78g,
相同质量的Al、Al(OH)3、Al2O3、AlCl3,Al(OH)3消耗NaOH最少,
故选B.
A.铝与氢氧化钠反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1gAl消耗NaOH质量=
| 1g×80 |
| 54 |
B.氢氧化铝与氢氧化钠反应为Al(OH)3+NaOH=NaAlO2+2H2O,1g氢氧化铝消耗氢氧化钠质量=
| 1g×40 |
| 78 |
C.AlCl3与氢氧化钠反应为AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,1g氯化铝消耗氢氧化钠质量=
| 1g×160 |
| 133.5 |
D.Al2O3与氢氧化钠反应为Al2O3+2NaOH=2NaAlO2+H2O,1g氧化铝消耗氢氧化钠的质量=
| 1g×80 |
| 102 |
相同质量的Al、Al(OH)3、Al2O3、AlCl3,Al(OH)3消耗NaOH最少,
故选B.
点评:本题考查铝及其化合物的性质、化学方程式有关计算,难度不大,注意基础知识的掌握.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
某酸溶液的PH为2,某碱溶液的PH为12,两者等体积相混合后,有关PH值的变化正确的是( )
| A、大于7 | B、小于7 |
| C、等于7 | D、三种都有可能 |
角鲨烯是一种高度不饱和烃类化合物,最初是从鲨鱼的肝脏中发现的,分子中含有多个双键,分子式为C30H50,具有生物氧化还原作用,从而增强机体的耐力与改善心脏功能,可用于癌症的防治,是一种无毒性的具有防病治病作用的海洋生物活性物质.下列叙述中正确的是( )
①能使KMnO4酸性溶液褪色
②能与氢气发生加成反应
③角鲨烯只含碳、氢两种元素
④角鲨烯易被氧化.
①能使KMnO4酸性溶液褪色
②能与氢气发生加成反应
③角鲨烯只含碳、氢两种元素
④角鲨烯易被氧化.
| A、①②③ | B、①③④ |
| C、②③④ | D、①②③④ |
某化学反应2M+N→3F是一步完成的,M和N的起始浓度分别为2mol/L和4mol/L,1秒钟后,M的浓度下降了1mol/L,下面结论中正确的是( )
| A、F的浓度为1.5mol/L |
| B、F的浓度为1mol/L |
| C、N的浓度为2.5mol/L |
| D、N的浓度为3mol/L |
现有bXn-和aYm+两种离子,它们的电子层结构相同,则a与下列式子有相等关系的是( )
| A、b-m-n |
| B、b+m+n |
| C、b-m+n |
| D、b+m-n |
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4═N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体先通过置于冰水浴的U型管,再通入足量的BaCl2溶液,结果为( )
| A、产生BaSO4和BaSO3沉淀 |
| B、无沉淀产生 |
| C、产生BaSO4沉淀 |
| D、产生BaSO3沉淀 |
下列说法正确的是( )
| A、蛋白质、淀粉、纤维素和油脂都是高分子有机物 |
| B、苯和乙酸乙酯都能发生取代反应 |
| C、煤干馏可得苯及甲苯等,是由于煤中含有苯及甲苯等物质 |
| D、淀粉、纤维素和蛋白质水解都生成葡萄糖 |
 (Ⅰ)已知:H+(aq)+OH-(aq)═H2O(l)△H1=-57.3kJ/mol
(Ⅰ)已知:H+(aq)+OH-(aq)═H2O(l)△H1=-57.3kJ/mol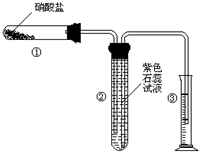 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体.(加热及夹持装置未画出)
某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体.(加热及夹持装置未画出)