题目内容
14.有如下四种物质:①CH2═CH2、②CH≡CH、③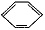 、④HCHO.下列说法正确的是( )
、④HCHO.下列说法正确的是( )| A. | 四种物质分子中,碳原子都是采取sp2杂化 | |
| B. | HCHO分子的空间构型为平面三角型,且分子中含有4个σ键 | |
| C. | 四种物质中所有原子都在同一平面内 | |
| D. | ①②两种有机物与H2发生加成反应时分子中的所有化学键发生断裂 |
分析 A.根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数;
B.单键为σ键,双键中具有1个σ键、1个π键,根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数;
C.根据CH2═CH2、 、HCHO是平面型分子,、CH≡CH是直线形分子;
、HCHO是平面型分子,、CH≡CH是直线形分子;
D.烯烃加成时断裂的是双键中的1个π键,δ键不断裂,炔烃加成时断裂的是双键中的2个π键,δ键不断裂.
解答 解:A.①CH2=CH2中碳原子成2个C-Hδ键,1个碳碳双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;②CH≡CH中碳原子成2个C-Hδ键,1个碳碳三键,三键中含有1个δ键、2个π键,杂化轨道数为1+1=2,所以碳原子采取sp杂化;③ 中碳原子成1个C-Hδ键,2个C-Cδ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化;④HCHO中碳原子成2个C-Hδ键,1个碳氧双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化,故A错误;
中碳原子成1个C-Hδ键,2个C-Cδ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化;④HCHO中碳原子成2个C-Hδ键,1个碳氧双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化,故A错误;
B.甲醛分子中含有碳氧双键,1个甲醛分子中含有2个碳氢σ键,1个碳氧σ键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化,因甲醛中碳原子采取sp2杂化,则分子的空间构型为平面三角,故B错误;
C.CH2═CH2、 、HCHO是平面型分子,所有原子都在同一平面内,CH≡CH是直线形分子,所有原子都在同一平面内,故C正确;
、HCHO是平面型分子,所有原子都在同一平面内,CH≡CH是直线形分子,所有原子都在同一平面内,故C正确;
D.①CH2═CH2、②CH≡CH与H2发生加成反应时,断裂的是分子中的π键,δ键不断裂,故D错误;
故选C.
点评 本题考查物质结构和性质,较为综合,涉及杂化类型的判断、化学键、原子共面等知识,是对学生分析、思维能力的考查,题目难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
4.下列物质满足条件的同分异构体数目错误的是(不考虑立体异构)( )
| 分子式或结构简式 | 满足条件的同分异构体数目 | |
| A | C3H7Cl | 2种 |
| B | C5H12O | 能与金属钠反应的结果有5种 |
| C |  | 一氯代物有2种 |
| D | C5H10O2 | 能与碳酸氢钠溶液反应的结构有4种 |
| A. | A | B. | B | C. | C | D. | D |
5.分子式C4H8O2的有机物与硫酸溶液共热可得有机物A和B.将A氧化最终可得C,且B和C为同系物.若C可发生银镜反应,则原有机物的结构简式为( )
| A. | HCOOCH2CH2CH3 | B. | CH3COOCH2CH3 | C. | CH3CH2COOCH3 | D. | HCOOC(CH3)3 |
2.下列说法正确的是( )
| A. | 氨基酸、蛋白质、油脂都含有C、H、O、N四种元素 | |
| B. | 乙烯、聚乙烯、甲苯均能使酸性高锰酸钾溶液褪色 | |
| C. | 糖类、油脂和蛋白质均属于高分子化合物 | |
| D. | 在加热、甲醛、饱和CuSO4溶液、X射线作用下,蛋白质都会发生变性 |
9.新鲜水果、蔬菜中富含的维生素C具有抗衰老作用.某学习小组利用碘滴定法测定维生素C的含量,发生的反应如下:

下列说法正确的是( )

下列说法正确的是( )
| A. | 该反应为取代反应 | |
| B. | 维生素C易溶于水,易被氧化 | |
| C. | 1 mol有机物甲最多能和2 mol H2反应 | |
| D. | 两种有机物中含有官能团的种类相同 |
6.关于苯的结构和性质叙述中,不正确的是( )
| A. | 苯分子中的原子位于同一平面 | B. | 苯的结构简式可表示为 | ||
| C. | 苯中碳碳键键角为60° | D. | 苯燃烧时能产生大量黑烟 |
3.有关下列物质分子结构特征描述正确的是( )
| A. | 1mol CH3CH2OH与Na完全反应只生成0.5 mol H2,不能说明乙醇分子中有一个氢原子与其它氢原子不同 | |
| B. | 苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构 | |
| C. |  和 和 属于同一种物质,不能用来解释甲烷是一种正四面体结构 属于同一种物质,不能用来解释甲烷是一种正四面体结构 | |
| D. | 乙烯容易与溴的四氯化碳溶液发生反应,且1mol乙烯完全加成消耗1mol溴单质,证明乙烯分子里含有一个碳碳双键 |
 实验室制取、收集干燥的以下6种气体:
实验室制取、收集干燥的以下6种气体: