题目内容
 (1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:
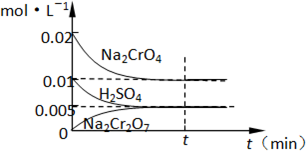
(1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:(2)在室温下,向0.02mol?L-1的Na2CrO4溶液中滴加0.01mol?L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,在此转化过程中,各物质浓度变化如图所示:该温度下,反应的平衡常数K=
(3)Ag2CrO4为砖红色沉淀,以2~3滴K2CrO4为指示剂,用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-).Ag2CrO4、AgCl的KSP分别为9.0×10-12和1.56×10-10.滴定过程中首先析出沉淀为
(4)该沉淀滴定要控制K2CrO4的浓度和溶液的PH值,其PH范围应在6.5~10.5,若PH<6.5实验结果偏高.请用平衡移动原理分析为什么结果会偏高.
考点:离子方程式的有关计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)Cr2O72-被Fe2+还原成Cr3+,Fe2+被氧化为Fe3+;
(2)CrO42-在酸性条件下转化为Cr2O72-;根据平衡常数用化学平衡的生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积计算;
(3)根据溶度积计算沉淀需要的Ag+的浓度,浓度小的首先转化为沉淀;由于存在2 CrO42-+2 H+?Cr2O72-+H2O,若小于6.5,氢离子浓度较大,则该平衡向右移动c(CrO42-)减小,形成沉淀时消耗的c(Ag+)偏大;
(4)由于存在2 CrO42-+2 H+?Cr2O72-+H2O,若小于6.5,氢离子浓度较大,则该平衡向右移动c(CrO42-)减小,形成沉淀时消耗的c(Ag+)偏大.
(2)CrO42-在酸性条件下转化为Cr2O72-;根据平衡常数用化学平衡的生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积计算;
(3)根据溶度积计算沉淀需要的Ag+的浓度,浓度小的首先转化为沉淀;由于存在2 CrO42-+2 H+?Cr2O72-+H2O,若小于6.5,氢离子浓度较大,则该平衡向右移动c(CrO42-)减小,形成沉淀时消耗的c(Ag+)偏大;
(4)由于存在2 CrO42-+2 H+?Cr2O72-+H2O,若小于6.5,氢离子浓度较大,则该平衡向右移动c(CrO42-)减小,形成沉淀时消耗的c(Ag+)偏大.
解答:
解:(1)Cr2O72-被Fe2+还原成Cr3+,Fe2+被氧化为Fe3+,其反应离子方程式为:Cr2O72-+6 Fe2++14H+=6 Fe3++2 Cr3++7 H2O,
故答案为:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;
(2)CrO42-在酸性条件下转化为Cr2O72-,其反应的方程式为:2CrO42-+2H+?Cr2O72-+H2O;化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,因此K=
=
=5×105(mol?L-1)-3;
故答案为:5×105(mol?L-1)-3;
(3)Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,设Na2CrO4和NaCl的浓度都为1mol/L,Ag2CrO4沉淀时需要的c(Ag+)=
=3×10-6,AgCl沉淀时需要的c(Ag+)=1.56×10-10,则AgCl先沉淀;
滴定过程中首先析出沉淀为AgCl,当氯离子完全沉淀以后,开始生成Ag2CrO4砖红色沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉;
故答案为:AgCl;加入最后一滴AgNO3溶液出现砖红色沉淀;
(4)由于存在2CrO42-+2H+?Cr2O72-+H2O,若小于6.5,氢离子浓度较大,则该平衡向右移动,c(CrO42-)减小,根据Ag2CrO4的KSP可知c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大,
故答案为:由于存在2CrO42-+2 H+?Cr2O72-+H2O,若小于6.5则该平衡向右移动c(CrO42-)减小,根据Ag2CrO4的KSP,c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大.
故答案为:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;
(2)CrO42-在酸性条件下转化为Cr2O72-,其反应的方程式为:2CrO42-+2H+?Cr2O72-+H2O;化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,因此K=
| c(Cr2O72-) |
| C2(CrO42-)×C(H+) |
| 5×10-3 |
| (1×10-2)2×1×10-2 |
故答案为:5×105(mol?L-1)-3;
(3)Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,设Na2CrO4和NaCl的浓度都为1mol/L,Ag2CrO4沉淀时需要的c(Ag+)=
| 9.0×10-12 |
滴定过程中首先析出沉淀为AgCl,当氯离子完全沉淀以后,开始生成Ag2CrO4砖红色沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉;
故答案为:AgCl;加入最后一滴AgNO3溶液出现砖红色沉淀;
(4)由于存在2CrO42-+2H+?Cr2O72-+H2O,若小于6.5,氢离子浓度较大,则该平衡向右移动,c(CrO42-)减小,根据Ag2CrO4的KSP可知c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大,
故答案为:由于存在2CrO42-+2 H+?Cr2O72-+H2O,若小于6.5则该平衡向右移动c(CrO42-)减小,根据Ag2CrO4的KSP,c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大.
点评:本题考查了沉淀滴定的原理和应用,题目难度较大,注意掌握难溶电解质的溶解平衡平衡常数的计算.注意把握题目信息.

练习册系列答案
相关题目
将CO2通入下列物质的溶液中,不与其反应的是( )
①Na2CO3②Na2SiO3③Na[Al(OH)4]④C6H5ONa ⑤Ca(ClO)2 ⑥CaCl2 ⑦CaCO3?
①Na2CO3②Na2SiO3③Na[Al(OH)4]④C6H5ONa ⑤Ca(ClO)2 ⑥CaCl2 ⑦CaCO3?
| A、①③④⑤⑥ | B、①和⑥ |
| C、只有① | D、只有⑥ |
我国镍氢电池居世界先进水平.常见镍氢电池的某极是储氢合金LaNi5H6 (LaNi5H6中各元素化合价均为零),电池反应通常表示为LaNi5H6+6NiO(OH)?LaNi5+6Ni(OH)2,下列说法正确的是( )
| A、放电时储氢合金作正极 |
| B、充电时阳极周围c(OH-)增大 |
| C、放电时负极反应:LaNi5H6+6OH--6e-=LaNi5+6H2O |
| D、充电时储氢合金作阳极 |
对于方程Al2O3+N2+3C=2AlN+3CO下列说法正确的是( )
| A、Al2O3做氧化剂 |
| B、N2是还原剂 |
| C、AlN既是氧化产物又是还原产物 |
| D、若有1mol CO生成,则反应中有2mol电子转移 |
1.4g铁全部溶于盐酸中,加入足量NaOH溶液,得红褐色沉淀,过滤后给红褐色沉淀加热(在空气中),最后得到红色物质的质量是( )
| A、2g | B、1.6g |
| C、1g | D、1.8g |
设NA代表阿伏加德罗常数的数值.下列有关叙述正确的是( )
| A、标准状况下,2.24LSO3含有的分子数等于0.1NA |
| B、1 mol CaC2所含阴离子数为2NA |
| C、常温常压下,16gO2 和O3的混合气体含有的氧原子数为NA |
| D、含有1mol Fe(OH)3的氢氧化铁胶体中胶粒数为NA |

 +H2O(-R1、R2表示氢原子或烃基)
+H2O(-R1、R2表示氢原子或烃基)
