题目内容
设NA代表阿伏加德罗常数的数值.下列有关叙述正确的是( )
| A、标准状况下,2.24LSO3含有的分子数等于0.1NA |
| B、1 mol CaC2所含阴离子数为2NA |
| C、常温常压下,16gO2 和O3的混合气体含有的氧原子数为NA |
| D、含有1mol Fe(OH)3的氢氧化铁胶体中胶粒数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标准状况三氧化硫不是气体;
B、碳化钙是钙离子和C22-构成分析;
C、依据氧原子守恒计算;
D、氢氧化铁胶体微粒是氢氧化铁的集合体.
B、碳化钙是钙离子和C22-构成分析;
C、依据氧原子守恒计算;
D、氢氧化铁胶体微粒是氢氧化铁的集合体.
解答:
解:A、标准状况三氧化硫不是气体,2.24LSO3含物质的量不是0.1mol,故A错误;
B、碳化钙是钙离子和C22-构成,1 mol CaC2所含阴离子数为NA,故B错误;
C、依据氧原子守恒计算,16gO2 和O3的混合气体含有的氧原子数=
×NA=NA,故C正确;
D、氢氧化铁胶体微粒是氢氧化铁的集合体,含有1mol Fe(OH)3的氢氧化铁胶体中胶粒数小于NA,故D错误;
故选C.
B、碳化钙是钙离子和C22-构成,1 mol CaC2所含阴离子数为NA,故B错误;
C、依据氧原子守恒计算,16gO2 和O3的混合气体含有的氧原子数=
| 16g |
| 16g/mol |
D、氢氧化铁胶体微粒是氢氧化铁的集合体,含有1mol Fe(OH)3的氢氧化铁胶体中胶粒数小于NA,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件分析,物质结构理解应用,胶体微粒的组成判断,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列事实:
①NaHCO3溶液呈碱性
②NaHSO4溶液呈酸性
③长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结
④加热能增加纯碱的去污能力
⑤配制CuCl2溶液,用稀盐酸溶解CuCl2固体
⑥明矾能净水
⑦氯化铵溶液可作焊药去除金属制品表面的锈斑
⑧加热FeCl3?6H2O晶体,往往得不到FeCl3固体
⑨NH4F溶液不能用玻璃瓶盛放.其中与盐类水解知识有关的是( )
①NaHCO3溶液呈碱性
②NaHSO4溶液呈酸性
③长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结
④加热能增加纯碱的去污能力
⑤配制CuCl2溶液,用稀盐酸溶解CuCl2固体
⑥明矾能净水
⑦氯化铵溶液可作焊药去除金属制品表面的锈斑
⑧加热FeCl3?6H2O晶体,往往得不到FeCl3固体
⑨NH4F溶液不能用玻璃瓶盛放.其中与盐类水解知识有关的是( )
| A、全部 | B、除②⑦以外 |
| C、除②以外 | D、除⑨以外 |
已知短周期元素的离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是( )
| A、原子半径:A>B>C>D |
| B、原子序数:d>c>b>a |
| C、离子半径:C3->D->B+>A2+ |
| D、元素的第一电离能:A>B>D>C |
下列说法正确的是( )
| A、电子在核外运动时有确定的轨道和轨迹,电子云就是对其运动轨迹的准确描述 |
| B、原子核外电子在某一时刻的位置可以测定或计算出来 |
| C、人们常用小黑点的疏密程度来表示电子在原子核外出现的概率的大小 |
| D、电子云图中的小黑点表示电子的个数多少 |
物质发生化学变化时,下列量在反应前后肯定不发生变化的是( )
①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥质子总数.
①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥质子总数.
| A、①②③⑤ | B、①②⑤⑥ |
| C、②③⑤⑥ | D、①④⑤ |
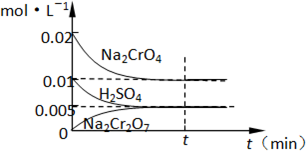 (1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:
(1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为: 将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:
将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答: