题目内容
下列离子反应方程式和相对应的化学方程式正确的是( )
| A、Ca2++2OH-=Ca(OH)2↓ CaCO3+2NaOH=Ca(OH)2↓+Na2CO3 |
| B、Ba2++SO42-=BaSO4↓ Ba(OH)2+H2SO4=BaSO4↓+2H2O |
| C、Ag++Cl-=AgCl↓ AgNO3+NaCl=AgCl↓+NaNO3 |
| D、Fe3++3OH-=Fe(OH)3↓ FeCl3+3NH3?H2O=Fe(OH)3↓+3NH4Cl |
考点:离子方程式的书写
专题:离子反应专题
分析:A.碳酸钙与氢氧化钠不满足离子反应发生条件,无法形成离子方程式;
B.氢氧化钡与硫酸反应生成硫酸钡沉淀和水;
C.硝酸银与氯化钠反应生成可溶性的硝酸钠和氯化银沉淀;
D.一水合氨为弱碱,离子方程式中一水合氨不能拆开,需要保留分子式.
B.氢氧化钡与硫酸反应生成硫酸钡沉淀和水;
C.硝酸银与氯化钠反应生成可溶性的硝酸钠和氯化银沉淀;
D.一水合氨为弱碱,离子方程式中一水合氨不能拆开,需要保留分子式.
解答:
解:A.CaCO3、NaOH之间不发生反应,不能用离子方程式Ca2++2OH-=Ca(OH)2↓表示,故A错误;
B.Ba(OH)2+H2SO4=BaSO4↓+2H2反应中除了生成硫酸钡沉淀,还生成了水,不能用Ba2++SO42-=BaSO4↓表示,故B错误;
C.AgNO3+NaCl=AgCl↓+NaNO3的离子方程式为:Ag++Cl-=AgCl↓,故C正确;
D.一水合氨不能拆开,FeCl3+3NH3?H2O=Fe(OH)3↓+3NH4Cl的离子方程式不能用Fe3++3OH-=Fe(OH)3↓表示,故D错误;
故选C.
B.Ba(OH)2+H2SO4=BaSO4↓+2H2反应中除了生成硫酸钡沉淀,还生成了水,不能用Ba2++SO42-=BaSO4↓表示,故B错误;
C.AgNO3+NaCl=AgCl↓+NaNO3的离子方程式为:Ag++Cl-=AgCl↓,故C正确;
D.一水合氨不能拆开,FeCl3+3NH3?H2O=Fe(OH)3↓+3NH4Cl的离子方程式不能用Fe3++3OH-=Fe(OH)3↓表示,故D错误;
故选C.
点评:本题考查了离子方程式的正误判断,为是高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→CH3COOH+C2H5O- | ||
B、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)2++2OH-
| ||
| C、向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | ||
| D、甘氨酸与氢氧化钠溶液反应:H2N-CH2COOH+OH-→H2N-CHCOO-+H2O |
用NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A、在标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
| B、1mol Cl2参加反应转移的电子数不一定为2NA |
| C、78g Na2O2固体中含有NA个阴离子 |
| D、足量的MnO2与500ml浓盐酸充分反应,产生了NA个Cl2分子,则盐酸的浓度一定大于8 mol/L |
下列物质中,属于非电解质的是( )
| A、液态汞 | B、硫酸钡 |
| C、液氨 | D、浓硝酸 |
化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A、无论是风力发电还是潮汐发电,都是将化学能转化为电能 |
| B、光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 |
| C、推广燃煤脱硫技术,可以防治SO2污染 |
| D、凡含有食品添加剂的食物对人体健康均有害,不宜食用 |
下列反应的离子方程式正确的是( )
| A、Ca(OH)2溶液中加入少量NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
| B、过量氯气通入FeBr2溶液中:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| C、二氧化硫气体通入碘水中:SO2+I2+2H2O=2H++SO42-+2HI |
| D、向明矾溶液中加入Ba(OH)2溶液至沉淀质量最大:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |


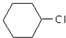 为原料合成重要的化工产品
为原料合成重要的化工产品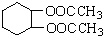 的路线流程图(无机试剂任选)合成路线流程图示例如图2.
的路线流程图(无机试剂任选)合成路线流程图示例如图2.