题目内容
在密闭容器中,反应:CH4(g)+H2O(g)?CO(g)+H2(g)△H>0,达到平衡,下列叙述不正确的是( )
| A、增加甲烷的量,△H增大 |
| B、增加水蒸气的量,可提高甲烷的转化率 |
| C、升高温度,逆反应速率增大 |
| D、增大体系压强,该反应的化学平衡常数不变 |
考点:化学平衡的影响因素
专题:
分析:A、△H的大小与化学方程式的书写有关,与加入反应物的多少无关;
B、增加水蒸气的量,平衡正向移动;
C、升高温度,正逆反应速率都增大;
D、化学平衡常数只受温度影响.
B、增加水蒸气的量,平衡正向移动;
C、升高温度,正逆反应速率都增大;
D、化学平衡常数只受温度影响.
解答:
解:A、△H的大小与化学方程式的书写有关,与加入反应物的多少无关,所以,增大甲烷的量,△H不变,故A错误;
B、增加水蒸气的量,平衡正向移动,甲烷的转化率增大,故B正确;
C、升高温度,正逆反应速率都增大,故C正确;
D、化学平衡常数只受温度影响,不随压强的改变而改变,故D正确;
故选A.
B、增加水蒸气的量,平衡正向移动,甲烷的转化率增大,故B正确;
C、升高温度,正逆反应速率都增大,故C正确;
D、化学平衡常数只受温度影响,不随压强的改变而改变,故D正确;
故选A.
点评:本题考查了焓变的大小与反应物多少的关系、平衡移动以及化学平衡常数的相关知识,题目难度不大.

练习册系列答案
相关题目
一定温度下容积恒定的密闭容器中,有可逆反应:A(s)+2B(g)?C(g)+D(g).当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度②容器内气体的压强③混合气体的总物质的量④混合气体平均分子量.
①混合气体的密度②容器内气体的压强③混合气体的总物质的量④混合气体平均分子量.
| A、①和④ | B、②和③ |
| C、②③④ | D、只有④ |
将足量BaCO3(Ksp=8.1×10-9) 分别加入:①30mL 水; ②10mL 0.2mol/LNa2CO3溶液; ③50mL 0.01mol/L 氯化钡溶液; ④100mL 0.01mol/L盐酸中溶解至溶液饱和.
请确定各溶液中Ba2+的浓度由大到小的顺序为( )
请确定各溶液中Ba2+的浓度由大到小的顺序为( )
| A、①②③④ | B、③④①② |
| C、④③①② | D、②①④③ |
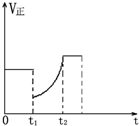 如图表示反应2SO2(g)+O2(g)═2SO3(g)△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
如图表示反应2SO2(g)+O2(g)═2SO3(g)△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )| A、t1时减小了SO2 的浓度,增加了SO3的浓度,平衡向逆反应方向移动 |
| B、t1时降低了温度,平衡向正反应方向移动 |
| C、t1时减小了压强,平衡向逆反应方向移动 |
| D、t1时增加了SO2 和O2的浓度,平衡向正反应方向移动 |
下列关于反应热及能量变化的说法正确的是( )
| A、当△H<0时,表示该反应为吸热反应 |
| B、放热反应可以自发进行,而吸热反应需加热才能进行 |
| C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
| D、化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
下列关于乙烯的说法错误的是( )
| A、乙烯的结构简式可以表示为CH2CH2 |
| B、收集乙烯可用排空气法 |
| C、可作香蕉等水果的催熟剂 |
| D、燃烧时火焰明亮,同时产生黑烟 |
立方烷(C8H8)的碳架结构如图,则它的五氯代物有( )种


| A、3 | B、4 | C、5 | D、6 |
0.2molNa218O2与足量CO2完全反应后,所得固体质量为( )
| A、21.2g |
| B、21.6g |
| C、22.0g |
| D、22.4g |