题目内容
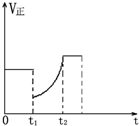 如图表示反应2SO2(g)+O2(g)═2SO3(g)△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
如图表示反应2SO2(g)+O2(g)═2SO3(g)△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )| A、t1时减小了SO2 的浓度,增加了SO3的浓度,平衡向逆反应方向移动 |
| B、t1时降低了温度,平衡向正反应方向移动 |
| C、t1时减小了压强,平衡向逆反应方向移动 |
| D、t1时增加了SO2 和O2的浓度,平衡向正反应方向移动 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:由图知在t1时刻V正减小,反应逆向进行,重新平衡时的速率大于原平衡速率,新平衡时反应物浓度比原来还大,结合平衡移动判断.
解答:
解:A、t1时减小了SO2的浓度,增加了SO3的浓度,平衡向逆反应移动,新平衡时反应物浓度比可以原来还大,平衡时正反应速率可以比原平衡速率大,故A正确;
B、t1降低了温度,平衡向正反应移动,重新平衡时的速率小于原平衡速率,故B错误;
C、t1时减小了压强,平衡向逆反应方向移动,重新平衡时的速率小于原平衡速率,故C错误;
D、t1时增加了SO2和O2的浓度,正反应速率应大于原平衡速率,平衡向正反应方向移动,故D错误.
故选:A.
B、t1降低了温度,平衡向正反应移动,重新平衡时的速率小于原平衡速率,故B错误;
C、t1时减小了压强,平衡向逆反应方向移动,重新平衡时的速率小于原平衡速率,故C错误;
D、t1时增加了SO2和O2的浓度,正反应速率应大于原平衡速率,平衡向正反应方向移动,故D错误.
故选:A.
点评:本题考查化学平衡图象、化学平衡移动等,难度中等,根据图象提取信息是解题的关键.

练习册系列答案
相关题目
要配制浓度为2mol?L-1NaOH溶液100mL,下面的操作正确的是( )
| A、称取8gNaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B、称取8gNaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C、称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀. |
| D、用100mL量筒量取40mL5mol?L-1NaOH溶液,倒入烧杯中,加水搅拌,将溶液转移至100mL容量瓶中,洗涤烧杯和玻璃棒并转移洗涤液,再加水至刻度,摇匀. |
在密闭容器中,反应:CH4(g)+H2O(g)?CO(g)+H2(g)△H>0,达到平衡,下列叙述不正确的是( )
| A、增加甲烷的量,△H增大 |
| B、增加水蒸气的量,可提高甲烷的转化率 |
| C、升高温度,逆反应速率增大 |
| D、增大体系压强,该反应的化学平衡常数不变 |
已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O═4Fe(OH)3↓+O2↑+8Na+则下列说法正确的是( )
| A、该反应中还原剂为Fe2+,O2、Fe(OH)3均为氧化产物 |
| B、充分反应后可以看到白色沉淀和气体生成 |
| C、标准状况下,每生成22.4 L O2,则有4 mol Na2O2被还原 |
| D、若有4 mol Na2O2参加反应,则反应中共转移6NA个电子 |
相对分子质量为M的某物质在室温下的溶解度为S g,此时测得饱和溶液的密度ρg?cm-3,则该饱和溶液的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|