题目内容
12.设NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 0.5 mol O2含氧原子数为0.5NA | B. | 1.8 g的NH4+中含有的电子数为NA | ||
| C. | 48 g O3含有的氧原子数为NA | D. | 1 mol H2O2中含NA个H2和NA个O2 |
分析 A.1个氧气分子含有2个氧原子;
B.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算;
C.臭氧由氧原子构成;
D.过氧化氢不含H2.
解答 解:A.0.5 mol O2含氧原子数为0.5mol×2×NA=NA,故A错误;
B.1个氨根离子含义10个电子,则1.8 g的NH4+物质的量为$\frac{1.8g}{18g/mol}$=0.1mol,含有的电子数为NA,故B正确;
C.臭氧由氧原子构成,48 g O3含有的氧原子物质的量为$\frac{48g}{16g/mol}$=3mol,个数为3NA,故C错误;
D.过氧化氢是由H和O构成,不含H2.故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.如图所示甲、乙是实验室试剂标签上的部分内容,下列说法正确的是( )

| A. | 该氨水的物质的量浓度约为6.3mol•L-1 | |
| B. | 各取5ml与等质量的水混合后,c(H2SO4)<9.2 mol•L-1,c(NH3)>6.45 mol•L-1 | |
| C. | 常温下铁不能与该硫酸反应 | |
| D. | 各取10ml于两烧杯中,再分别加入一定量的水即可得到较稀的硫酸溶液和氨水 |
3.向一潮湿的容器中通入H2S和SO2的混合气体共1mol.充分反应后所得氧化产物比还原产物多8g.则通入的SO2和H2S的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
20.向含amolBa(OH)2的溶液中逐滴加入含bmolNaHCO3的溶液,充分反应(不考虑盐类的水解反应及沉淀溶解).下列说法不正确的是( )
| A. | a=2b时,生成沉淀98.5ag | |
| B. | a≤b≤2a时,溶液中含n(NaOH):n(Na2CO3)=(2a-b):(b-a) | |
| C. | 0<b<2a时,沉淀质量随着NaHCO3的加入而不断增加 | |
| D. | b=$\frac{3}{2}$a时,总离子方程式为:3HCO3-+2Ba2++3OH-=2BaCO3↓+CO32-+3H2O |
7.下列物质一定表示一种纯净物的是( )
| A. | C3H6 | B. | C2H4 | C. | [-CH2-CH2-]n | D. | C4H10 |
2.将5mL 0.4molL -1AgNO3溶液与10mL 0.3molL -1BaCl2溶液混合,反应后溶液中离子浓度最大的是( )
| A. | Ag + | B. | NO ${\;}_{3}^{-}$ | C. | Cl- | D. | Ba2+ |
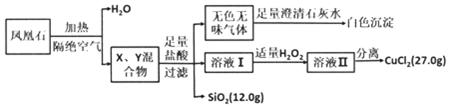
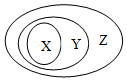 用如图表示的一些物质或概念间的从属关系中,正确的是( )
用如图表示的一些物质或概念间的从属关系中,正确的是( )