题目内容
2.如图所示甲、乙是实验室试剂标签上的部分内容,下列说法正确的是( )
| A. | 该氨水的物质的量浓度约为6.3mol•L-1 | |
| B. | 各取5ml与等质量的水混合后,c(H2SO4)<9.2 mol•L-1,c(NH3)>6.45 mol•L-1 | |
| C. | 常温下铁不能与该硫酸反应 | |
| D. | 各取10ml于两烧杯中,再分别加入一定量的水即可得到较稀的硫酸溶液和氨水 |
分析 A.依据c=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度;
B.根据混合前后溶质的质量不变来计算;
C.依据c=$\frac{1000ρω}{M}$计算硫酸的物质的量浓度,铁与浓硫酸常温下钝化;
D.浓硫酸稀释时放热.
解答 解:A.密度0.88g/mL质量分数25%的氨水的物质的量浓度C=$\frac{1000×0.88×25%}{17}$=12.9mol/L,故A错误;
B.设浓硫酸原来的质量为m,则硫酸的质量分数$\frac{m×98%}{2m}$=49%,硫酸的浓度越小,密度越小,则硫酸的物质的量浓度小于9.2mol/L;设氨水原来的质量为m,则稀释后氨水的质量分数为$\frac{m×25%}{2m}$,而氨水的浓度越小,密度越大,故氨水的物质的量浓度大于6.45mol/L,故B正确;
C.该硫酸物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,该硫酸为浓硫酸,常温下与铁发生钝化,故C错误;
D.浓硫酸稀释时放热,故一定要将浓硫酸注入水中,故D错误;
故选:B.
点评 本题考查了物质的量浓度有个计算,明确以物质的量为核心计算公式是解题关键,注意钝化属于化学变化,注意浓硫酸稀释的正确操作,题目难度不大.

练习册系列答案
相关题目
13.甲、乙两种物质的溶解曲线如图所示.下列说法正确的是( )
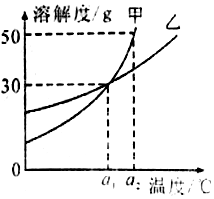

| A. | a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液 | |
| B. | 甲和乙的溶解度相等 | |
| C. | a1℃时,甲和乙各30g分别加入100g的水中,均形成饱和溶液 | |
| D. | a2℃时,在100g水中加入60g甲,形成不饱和溶液 |
10.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 22.4 L乙烷分子中的碳原子数目为2NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA | |
| C. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
14.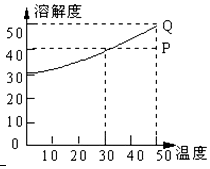 有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )
有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )
 有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )
有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )| A. | 50℃时,若该盐溶液含A克溶质,保持温度不变,加入A/4 g溶质,溶液必变成饱和溶液 | |
| B. | 50℃时,140g P点溶液最少需蒸发掉20g水才能形成饱和溶液 | |
| C. | 该溶液冷却至0℃时,析出溶质10 g | |
| D. | 在保持溶质及溶剂质量不变的情况下,使P点溶液达到饱和需降温20℃ |
11.在温度相同时,100mL0.01mol/L的CH3OOH溶液与10mL0.1mol/LCH3COOH溶液相比较,下列叙述中前者大于后者的是( )
| A. | CH3OOH的物质的量 | |
| B. | 溶液中的n(H+) | |
| C. | 用同浓度的NaOH溶液恰好完全反砬,消耗NaOH溶液的体积 | |
| D. | 溶液的导电能力 |
12.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 0.5 mol O2含氧原子数为0.5NA | B. | 1.8 g的NH4+中含有的电子数为NA | ||
| C. | 48 g O3含有的氧原子数为NA | D. | 1 mol H2O2中含NA个H2和NA个O2 |