��Ŀ����
 A��B��C�����ֳ���������Ԫ�صĵ��ʣ�������DΪ��ɫҺ�壬E��һ�ֳ������������壬F�ǻ������ת����ϵ��ͼ����Ӧ�����Ͳ��ֲ�����ȥ����
A��B��C�����ֳ���������Ԫ�صĵ��ʣ�������DΪ��ɫҺ�壬E��һ�ֳ������������壬F�ǻ������ת����ϵ��ͼ����Ӧ�����Ͳ��ֲ�����ȥ�����Իش�
��1��E �ĵ���ʽ��
��2������X��B��D���ܷ�Ӧ���ɺ�ɫ����Y��Y�Ļ�ѧʽ��
д��X��D����Y�Ļ�ѧ����ʽ��
�� 3��д�� F�� E��Ӧ�Ļ�ѧ����ʽ��
��4��E �Ĵ����ŷŻ�����ܶ�����⣮�п�ѧ���������E�� H2�ϳ�CH3OH��H2O����E�����ۺ����ã� 25�棬101kPaʱ�÷�Ӧ���Ȼ�ѧ����ʽ��
�� ��֪�״���ȼ���ȡ�H=-726.5kJ/mol��������ȼ���ȡ�H=-285.8kJ?mol-1 ��
���㣺������ƶ�
ר�⣺�ƶ���
������A��B��C�����ֳ���������Ԫ�صĵ��ʣ�A��B��Ӧ����D��������DΪ��ɫҺ�壬DӦΪH2O��E��һ�ֳ������������壬ӦΪCO2����AΪH2��BΪO2��CΪ̼��D��E����F��Ӧ������������FΪNa2O2���ݴ˽��
��1��CO2������̼ԭ������ԭ��֮���γ�2�Թ��õ��Ӷԣ����������������ӻ����������������������ӹ��ɣ���������������ԭ��֮���γɹ��ۼ���
��2������X��B��D���ܷ�Ӧ���ɺ�ɫ���Թ���Y����XΪFe��YΪ������������
��3�����������������̼��Ӧ����̼������������
��4�����ݼ״���������ȼ���ȣ���д��ȼ�յ��Ȼ�ѧ����ʽ���ٸ��ݸ�˹����д��������̼�������ϳɼ״���ˮ���Ȼ�ѧ����ʽ����ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ���ʱ䣮
��1��CO2������̼ԭ������ԭ��֮���γ�2�Թ��õ��Ӷԣ����������������ӻ����������������������ӹ��ɣ���������������ԭ��֮���γɹ��ۼ���
��2������X��B��D���ܷ�Ӧ���ɺ�ɫ���Թ���Y����XΪFe��YΪ������������
��3�����������������̼��Ӧ����̼������������
��4�����ݼ״���������ȼ���ȣ���д��ȼ�յ��Ȼ�ѧ����ʽ���ٸ��ݸ�˹����д��������̼�������ϳɼ״���ˮ���Ȼ�ѧ����ʽ����ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ���ʱ䣮
���
�⣺A��B��C�����ֳ���������Ԫ�صĵ��ʣ�A��B��Ӧ����D��������DΪ��ɫҺ�壬DӦΪH2O��E��һ�ֳ������������壬ӦΪCO2����AΪH2��BΪO2��CΪ̼��D��E����F��Ӧ������������FΪNa2O2��
��1��EΪCO2������ʽ�� ��FΪNa2O2���������Ӽ������ۼ���
��FΪNa2O2���������Ӽ������ۼ���
�ʴ�Ϊ�� �����Ӽ������ۼ���
�����Ӽ������ۼ���
��2������X��������ˮ���ܷ�Ӧ���ɺ�ɫ����Y����XΪFe��YΪFe3O4��Fe��ˮ���������������Ļ�ѧ����ʽ�ǣ�3Fe+4H2O��g��
Fe3O4+4H2��
�ʴ�Ϊ��Fe3O4��3Fe+4H2O��g��
Fe3O4+4H2��
�� 3��F�� E��Ӧ�Ļ�ѧ����ʽ�ǣ�2Na2O2+2CO2=2Na2CO3+O2��
�ʴ�Ϊ��2Na2O2+2CO2=2Na2CO3+O2��
��4���״���ȼ���ȡ�H=-726.5kJ?mol-1���ɵü״�ȼ�յ��Ȼ�ѧ����ʽ����CH3OH��l��+
O2��g���TCO2��g��+2H2O��l����H=-726.5 kJ?mol-1��
������ȼ���ȡ�H=-285.8kJ?mol-1���ɵ�����ȼ�յ��Ȼ�ѧ����ʽ����H2��g��+
O2��g���TH2O��l����H=-285.8 kJ?mol-1��
���ݸ�˹���ɣ��ڡ�3-�ٵã�CO2��g��+3H2��g��=CH3OH��l��+H2O��1����H=-130.9kJ/mol��
�ʴ�Ϊ��CO2��g��+3H2��g��=CH3OH��l��+H2O��1����H=-130.9kJ/mol��
��1��EΪCO2������ʽ��
 ��FΪNa2O2���������Ӽ������ۼ���
��FΪNa2O2���������Ӽ������ۼ����ʴ�Ϊ��
 �����Ӽ������ۼ���
�����Ӽ������ۼ�����2������X��������ˮ���ܷ�Ӧ���ɺ�ɫ����Y����XΪFe��YΪFe3O4��Fe��ˮ���������������Ļ�ѧ����ʽ�ǣ�3Fe+4H2O��g��
| ||
�ʴ�Ϊ��Fe3O4��3Fe+4H2O��g��
| ||
�� 3��F�� E��Ӧ�Ļ�ѧ����ʽ�ǣ�2Na2O2+2CO2=2Na2CO3+O2��
�ʴ�Ϊ��2Na2O2+2CO2=2Na2CO3+O2��
��4���״���ȼ���ȡ�H=-726.5kJ?mol-1���ɵü״�ȼ�յ��Ȼ�ѧ����ʽ����CH3OH��l��+
| 3 |
| 2 |
������ȼ���ȡ�H=-285.8kJ?mol-1���ɵ�����ȼ�յ��Ȼ�ѧ����ʽ����H2��g��+
| 1 |
| 2 |
���ݸ�˹���ɣ��ڡ�3-�ٵã�CO2��g��+3H2��g��=CH3OH��l��+H2O��1����H=-130.9kJ/mol��
�ʴ�Ϊ��CO2��g��+3H2��g��=CH3OH��l��+H2O��1����H=-130.9kJ/mol��
���������⿼�������ƶϡ����û�ѧ����Ȼ�ѧ����ʽ��д�ȣ���Ŀ�Ƚ��ۺϣ��ƶ������ǹؼ����Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
CO�ڸ����»�ԭa g���������õ�b g�������������ԭ�������ǣ�������
A��
| ||
B��
| ||
C��
| ||
D��
|
����˵����ȷ���ǣ�������
| A����ѧ��Ӧ�����ǶԿ��淴Ӧ���Եģ��ǿ��淴Ӧ��̸��ѧ��Ӧ���� |
| B���ڿ��淴Ӧ�У�����Ӧ�Ļ�ѧ��Ӧ��������ֵ���淴Ӧ�Ļ�ѧ��Ӧ�����Ǹ�ֵ |
| C����ͬһ��ѧ��Ӧ�У��仯ѧ��Ӧ���ʿ����÷�Ӧ��Ũ�ȵĸı�����ʾ��Ҳ������������Ũ�ȵĸı�����ʾ����ֵ������ͬ��Ҳ���ܲ���ͬ |
| D����ѧ��Ӧ���ʵĵ�λ������g/L?s��Ҳ������kg/L?s������������t/L?s������ʾ |

 ��
�� ��
�� ��
�� ijѧ�������ͼ��ʾ��ʵ��װ�ã����������볱ʪ����ʯ�ҷ�Ӧ��ȡ����Ư�ۣ�����һ�����ȷ�Ӧ�����ݴ˻ش��������⣺
ijѧ�������ͼ��ʾ��ʵ��װ�ã����������볱ʪ����ʯ�ҷ�Ӧ��ȡ����Ư�ۣ�����һ�����ȷ�Ӧ�����ݴ˻ش��������⣺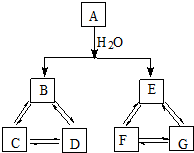 ��A��B��C��D��E��F��G���ֳ������ʣ�����������ͼ��ʾת����ϵ����֪��
��A��B��C��D��E��F��G���ֳ������ʣ�����������ͼ��ʾת����ϵ����֪�� �Ľṹ��ʽ
�Ľṹ��ʽ �ļ���ʽ
�ļ���ʽ �ķ���ʽ
�ķ���ʽ