题目内容
乙烯是石油裂解的主要产物之一.将乙烯通入溴水中,观察到的现象是 ;其反应方程式为 .乙烯在一定条件下发生加聚反应的化学方程式是 ;乙烯对水果具有 功能.
考点:乙烯的化学性质
专题:有机反应
分析:根据乙烯中的官能团双键所具有的性质来分析,根据加成反应、加聚反应的特点和方式来书写方程式,根据乙烯的用途来回答.
解答:
解:乙烯中的官能团为双键,能够和溴加成,故将乙烯通入溴的四氯化碳溶液中,观察到的现象是溴的红棕色褪去;加成反应的特点是双键变单键,断键处加上加成试剂原子即可,方程式为Br2+CH2=CH2→BrCH2-CH2Br;
根据加聚反应的特点,双键变单键,断开的单键相连接形成高分子化合物,故方程式为:nCH2═CH2
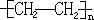 ,产物名称为聚乙烯;
,产物名称为聚乙烯;
乙烯的重要用途是用于对水果催熟;
故答案为:溴水的红棕色褪去;Br2+CH2=CH2→BrCH2-CH2Br;nCH2═CH2
 ;催熟.
;催熟.
根据加聚反应的特点,双键变单键,断开的单键相连接形成高分子化合物,故方程式为:nCH2═CH2
| 催化剂 |
 ,产物名称为聚乙烯;
,产物名称为聚乙烯;乙烯的重要用途是用于对水果催熟;
故答案为:溴水的红棕色褪去;Br2+CH2=CH2→BrCH2-CH2Br;nCH2═CH2
| 催化剂 |
 ;催熟.
;催熟.
点评:本题考查了乙烯的化学性质和用途,是一道基本知识题目,难度不大,注意有机化学方程式的书写.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
 实验室用氯酸钾和二氧化锰的混合物加热,并用排水法收集氧气的实验步骤主要有(1)检查装置的气密性,(2)点燃酒精灯加热,(3)加药品并固定试管,(4)收集氧气,(5)熄灭酒精灯,(6)把导管撤离出水面.其中正确的实验顺序为( )
实验室用氯酸钾和二氧化锰的混合物加热,并用排水法收集氧气的实验步骤主要有(1)检查装置的气密性,(2)点燃酒精灯加热,(3)加药品并固定试管,(4)收集氧气,(5)熄灭酒精灯,(6)把导管撤离出水面.其中正确的实验顺序为( )| A、(1)(3)(2)(4)(5)(6) |
| B、(1)(3)(2)(4)(6)(5) |
| C、(1)(2)(3)(4)(5)(6) |
| D、(1)(2)(3)(4)(6)(5) |
下列实验操作或事故处理中,做法不正确的是( )
| A、不慎将酸溅入眼中,立即用水冲洗,边洗边眨眼睛 |
| B、不慎将碱液沾到皮肤上,立即用大量水冲洗,然后涂上硼酸溶液 |
| C、不慎碰翻酒精灯导致失火,马上用湿抹布扑灭 |
| D、稀释浓硫酸时,先把浓硫酸注入量筒,然后向其中加入水,边加边搅拌 |
氢化钠是一种离子化合物,它跟水反应时生成氢氧化钠和氢气,反应方程式为NaH+H2O═NaOH+H2↑,将氢化钠和铝粉的混合物mg与足量的水充分反应后,若收集到ng氢气,则混合物中的铝的质量为( )
| A、(36n-3m)g |
| B、(m-4.8n)g |
| C、(12n-m)g |
| D、(24m-5n)g |
在玻璃、水泥和高炉炼铁工业生产中,都需要的原料是( )
| A、石灰石 | B、纯碱 | C、粘土 | D、石英 |

 A、B、C是三种常见短周期元素的单质,常温下D为无色液体,E是一种常见的温室气体,F是化合物.其转化关系如图(反应条件和部分产物略去).
A、B、C是三种常见短周期元素的单质,常温下D为无色液体,E是一种常见的温室气体,F是化合物.其转化关系如图(反应条件和部分产物略去). Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.