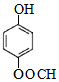
题目内容
14.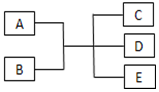 已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如图反应关系.
已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如图反应关系.(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为2NO3-+3Cu+8H+=2NO↑+4H2O+3Cu2+,若反应放出1.12L气体(标准状况下),则被还原的B物质的量为0.05mol.
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;实验室检验C的方法为把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气(或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气).
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为试纸变为蓝色.
分析 A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,则E为H2O,
(1)A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,则A为Cu,B为稀硝酸,C为NO,D为硝酸铜;
(2)C是一种无色、刺激性气味、密度比空气小的气体,则C为NH3,实验室利用铵盐与熟石灰反应制备氨气,利用湿润的红色石蕊试纸检验氨气;
(3)B是黄绿色有毒气体,则B为Cl2,实验室利用氢氧化钠溶液吸收氯气尾气,利用湿润的淀粉碘化钾试纸检验氯气,以此来解答.
解答 解:A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,则E为H2O,
(1)A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,则A为Cu,B为稀硝酸,C为NO,D为硝酸铜,反应的离子反应为2NO3-+3Cu+8H+=2NO↑+4H2O+3Cu2+,反应中若有2个硝酸被还原,则生成2个NO,所以若反应放出1.12L气体(标准状况下),则被还原的B物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,故答案为:2NO3-+3Cu+8H+=2NO↑+4H2O+3Cu2+;0.05;
(2)C是一种无色、刺激性气味、密度比空气小的气体,则C为NH3,实验室利用铵盐与熟石灰反应制备氨气,该反应为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;检验方法为把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气(或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气),
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气(或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气);
(3)B是黄绿色有毒气体,则B为Cl2,实验室利用氢氧化钠溶液吸收氯气尾气,所以反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;因为氯气具有氧化性,则用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为试纸变为蓝色,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;试纸变为蓝色.
点评 本题考查无机物的推断,侧重物质性质的考查,涉及浓硝酸、氯气的吸收及氨气的制备,明确发生的化学反应即可解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | pH=5的下列溶液(①NH4Cl溶液②CH3COOH溶液;③稀盐酸)中由水电离出来的c(H+)水 ①>②>③ | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| D. | pH相同的下列三种溶液(①CH3COONa、②NaHCO3、③NaClO)中的c(Na+):①>②>③ |
| A. | 质子数为35、中子数为45的溴原子:3545Br | |
| B. | Al3+的结构示意图: | |
| C. | 羟基的电子式: | |
| D. | 乙醇的结构简式:C2H6O |
| A. | 5.6 g铁与盐酸反应时失去的电子数目为0.3 NA | |
| B. | 71 g氯气所含原子数目为NA | |
| C. | 标准状况下,以任意比混合的氮气和氧气11.2 L,所含的分子数为0.5 NA | |
| D. | 在25℃,1.01×105Pa时,22.4 L氢气所含的原子数目为2 NA |
| A. | 28 g铁粉与酸反应失去的电子数是NA | |
| B. | 标准状况下,11.2 L NH3含有的原子总数为1.5NA | |
| C. | 0.5 mol•L-1 K2SO4溶液中所含K+的数目为NA | |
| D. | 46 g N02和N2O4的混合气体含有的原子总数为3NA |
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②下列措施能用勒夏特列原理解释是ad.(填序号)
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应
式NH3.H2O(aq)+H2SO4(aq)=NH4HSO4(aq)+H2O(l)△H=-5Q kJ•mol-1.
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl-),则一水合
氨的电离平衡常数Kb=$\frac{1{0}^{-7}b}{a-b}$.(用ab表示)
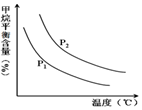
(4)原料气H2可通过反应 CH4(g)+H2O (g)?CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2
(填“>”、“=”或“<”).
②其它条件一定,升高温度,氢气的产率会增大.(填“增大”,“减小”减小,“不变”不变)
(5)原料气H2还可通过反应CO(g)+H2O(g)?CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变 b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
| A. | 氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO 3-═3Fe 3++2H2O+NO↑ | |
| B. | 氧化亚铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | 固体氯化钠与浓硫酸混合加热:H 2SO 4+2Cl-═SO 2↑+Cl 2↑+H 2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |

| A. | a为A2X3,b为AX3 | B. | a为AX3,b为AX2 | C. | a为AX2,b为AX3 | D. | a为AX3,b为A2X3 |
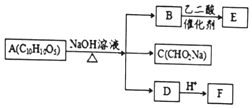 某芳香化合物A有如下转化:
某芳香化合物A有如下转化: 1mol F 最多消耗2mol NaOH.
1mol F 最多消耗2mol NaOH.