题目内容
9.设NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 5.6 g铁与盐酸反应时失去的电子数目为0.3 NA | |
| B. | 71 g氯气所含原子数目为NA | |
| C. | 标准状况下,以任意比混合的氮气和氧气11.2 L,所含的分子数为0.5 NA | |
| D. | 在25℃,1.01×105Pa时,22.4 L氢气所含的原子数目为2 NA |
分析 A.铁与盐酸反应生成氯化亚铁;
B.依据n=$\frac{m}{M}$计算氯气的物质的量,结合1个氯气含有2个氯原子解答;
C.根据标况下的气体摩尔体积计算出混合气体的物质的量,再根据氮气和氧气的分子构成计算出含有的原子数;
D.在25℃,1.01×105Pa时,Vm>22.4L/mol.
解答 解:A.5.6 g铁物质的量为$\frac{5.6g}{56g/mol}$=0.1mol,与盐酸反应时失去的电子数目为0.2 NA,故A错误;
B.71 g氯气所含原子数目为$\frac{71g}{71g/mol}$×2×NA=2NA,故B错误;
C.标况下,11.2L氮气与氧气的混合气体的物质的量为0.5mol,所含的分子数为0.5mol×NA=0.5NA,故C正确;
D.在25℃,1.01×105Pa时,Vm>22.4L/mol,22.4 L氢气物质的量小于1mol,所含的原子数目小于2 NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数应用,明确物质的量与阿伏伽德罗常数、气体摩尔体积、摩尔质量等之间的转化关系是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
20.在给定条件下,下列选项中所示的物质间转化都能一步实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$→_{点燃}^{CO_{2}}$Na2CO3 | |
| B. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| C. | Al2O3$\stackrel{H_{2}O}{→}$Al(OH)3$\stackrel{盐酸}{→}$AlCl3 | |
| D. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
4.下列指定反应的离子方程式正确的是( )
| A. | 向[Ag(NH3)2]OH溶液中加入盐酸:Ag++Cl-═AgCl↓ | |
| B. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | NH4HCO3溶液与足量NaOH溶液共热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NH3↑+2H2O |
1.化学与科学技术发展进步密切相关.下列说法正确的是( )
| A. | “人造太阳”实验发生的反应:${\;}_{1}^{2}$H+${\;}_{1}^{3}$H→${\;}_{2}^{4}$He+${\;}_{0}^{1}$n,属于化学反应 | |
| B. | 长征5号推进剂液氧一煤油比长征2号推进剂N2O4-(CH3)2NNH2更环保 | |
| C. | 在某催化剂表面CO2与H2O可合成乙醇并生成O2,该反应属于放热反应 | |
| D. | 包裹聚氨酯海绵的蚕在太空成功结茧,聚氨酯海绵和蚕丝均属于天然高分子 |
18.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在标准情况下,22.4LH2O含有的分子数为NA | |
| B. | 1L 0.1 mol?L-1的MgCl2溶液中含Mg2+的数目为0.1NA | |
| C. | 17.6g丙烷中所含的共价键数目为4NA | |
| D. | 20 ml 2mol?L-1 H2O2完全分解,转移的电子数为0.08NA |
19.下列各组离子不可能大量共存的是( )
| A. | 与铝反应放出氢气的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | c(HCO3-)=0.1mol•L-1的溶液中:Na+、K+、CO32-、Br- | |
| C. | 在由水电离出的c(OH-)=10-18 mol•L-1的溶液中Na+、Mg2+、NO3-、I- | |
| D. | 在能使pH试纸变深蓝色的溶液中:Na+、S2-、CO32-、NO3-、 |
 PH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )
PH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )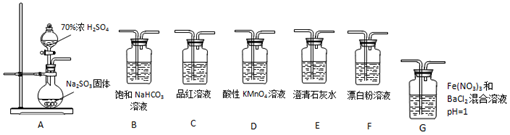
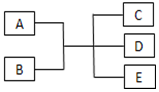 已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如图反应关系.
已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如图反应关系.