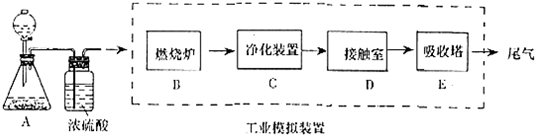
题目内容
14. 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.
影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.药品:Cu、Fe、Na和不同浓度的硫酸 (0.5mol/L、2mol/L、18.4mol/L);装置如图
(1)用此装置进行定量实验,应选用的上述实验药品是:
第一组:Fe和0.5mol/L硫酸
第二组:Fe和2mol/L硫酸
(2)应该测定的实验数据是气体从反应开始到推动活塞达到30mL刻度时的时间.
(3)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的):温度对反应速率的影响.
(4)此实验得到的结论应该是硫酸的浓度越高,反应速率越快.(填“高、低、快、慢”)
分析 研究不同浓度的硫酸对反应速率的影响,则控制Fe的量及表面积相同,只改变硫酸的浓度,测定一定体积气体需要的时间,可知浓度越大,需要的时间越少,以此来解答.
解答 解:(1)用此装置进行定量实验,应选用的上述实验药品是Fe、0.5mol/L硫酸;或 Fe、2mol/L硫酸,只控制硫酸的浓度不同,
故答案为:Fe;0.5mol/L硫酸;Fe;2mol/L硫酸;
(2)测定的实验数据是气体从反应开始到推动活塞达到30ml刻度时的时间,故答案为:时间;
(3)此实验忽视了影响反应速率的其他因素是温度对反应速率的影响,因金属与酸反应为放热反应,故答案为:温度对反应速率的影响;
(4)实验得到的结论应该是硫酸的浓度越高,反应速率越快,故答案为:高;快.
点评 本题考查反应速率的测定,为高频考点,把握控制变量法测定反应速率为解答的关键,侧重分析与实验能力的考查,注意金属与酸的反应为放热反应,题目难度不大.

练习册系列答案
相关题目
3.电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过下述流程回收Na2Cr2O7等物质.
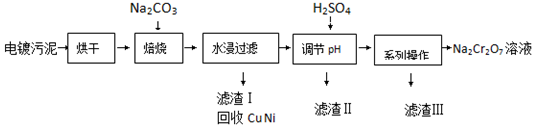
已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
(1)焙烧过程中生成Na2CrO4的化学方程式为4Cr(OH)3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+6H2O+4CO2;水浸后溶液中除Na2CrO4还存在的溶质有NaAlO2和Na2ZnO2;
(2)加入H2SO4调节pH的目的为除去溶液中NaAlO2、Na2ZnO2杂质,并将CrO42-转化为Cr2O72-;
(3)得到滤渣Ⅲ的“系列操作”的步骤为蒸发浓缩、冷却结晶 过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42-有8/9转化为Cr2O72-,求转化后所得溶液中c(Cr2O72-)=0.2mol•L-1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2,再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5,则发生反应的化学方程式为Na2Cr2O7+4H2O2+H2SO4═2CrO5+Na2SO4+5H2O.

已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
(2)加入H2SO4调节pH的目的为除去溶液中NaAlO2、Na2ZnO2杂质,并将CrO42-转化为Cr2O72-;
(3)得到滤渣Ⅲ的“系列操作”的步骤为蒸发浓缩、冷却结晶 过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42-有8/9转化为Cr2O72-,求转化后所得溶液中c(Cr2O72-)=0.2mol•L-1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2,再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5,则发生反应的化学方程式为Na2Cr2O7+4H2O2+H2SO4═2CrO5+Na2SO4+5H2O.
2.反应NO+O2+NO2+H2O→HNO3是多组化学计量数的化学方程式,当氧气有$\frac{1}{3}$被NO还原时,此方程式中各物质的化学计量数依次为( )
| A. | 4、9、24、14、28 | B. | 1、1、1、1、2 | C. | 8、9、12、10、20 | D. | 任意比均可 |
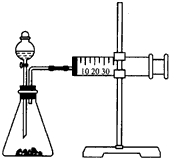
19. 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体,继续滴加液溴滴完.装置d的作用是吸收HBr和Br2;a中发生的化学反应方程式 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.
NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
加入氯化钙的目的是干燥;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体,继续滴加液溴滴完.装置d的作用是吸收HBr和Br2;a中发生的化学反应方程式
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.
NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
加入氯化钙的目的是干燥;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
3.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:CrO${\;}_{4}^{2-}$$→_{转换}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{还原}^{Fe_{2}+}$Cr(OH)3.已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l).转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2O72-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4 g | |
| C. | 常温下转化反应的平衡常数K=l04,则转化后所得溶液的pH=1 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,应调溶液的pH=5 |

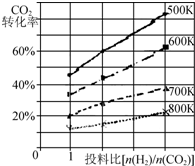 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);△H
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);△H