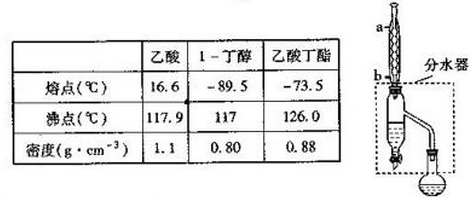
题目内容
10.现有①铜片、②NaCl、③NH3、④醋酸、⑤CO2、⑥盐酸、⑦浓H2SO4、⑧KOH、⑨蔗糖、⑩H2CO3,其中属于电解质的是②④⑧⑩,属于非电解质的③⑤⑨(填序号)分析 电解质是指:在水溶液中或熔融状态下能够导电的化合物,常见的电解质有酸、碱、盐和金属氧化物、水等;
非电解质是指:在水溶液里和熔融状态下都不导电的化合物,常见的非电解质有蔗糖、酒精、非金属氧化物和氨气等,据此分析.
解答 解:①铜片是电解质,既不是电解质也不是非电解质;
②NaCl是盐,是电解质;
③NH3在水溶液中和熔融状态下均不能导电,故为非电解质;
④醋酸是酸,故为电解质;
⑤CO2在水溶液中和熔融状态下均不能导电,故为非电解质;
⑥盐酸是混合物,故既不是电解质也不是非电解质;
⑦浓H2SO4是混合物,故既不是电解质也不是非电解质;
⑧KOH是碱,故为电解质;
⑨蔗糖在水溶液中和熔融状态下均不能导电,故是非电解质;
⑩H2CO3是酸,故为电解质.
故属于电解质的是②④⑧⑩,③⑤⑨.
故答案为:②④⑧⑩;③⑤⑨.
点评 本题主要考查电解质、非电解质的概念,题目难度不大,注意单质和混合物既不是电解质也不是非电解质.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
20.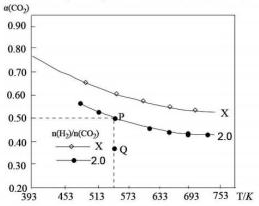 在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
 在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 若起始时,CO2、H2、浓度分分别为0.5mol/L和1.0mol/L,则可得P点,对应温度的平衡常数的值为512 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4、H2O,再次平衡后a(CO2)减小 |
15.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1LC2H5OH燃烧后生成的CO2分子数约为$\frac{{N}_{A}}{11.2}$ | |
| B. | 电解食盐水水时,当产生22.4LH2时,电路中转移的电子数为2NA | |
| C. | 标准状况下,11.2LCH4和C2H4混合气体中含有碳原子的数目为2NA | |
| D. | NH3易溶于水,3.4gNH3溶于1LH2O,溶液中氮原子总数为0.6NA |
2.反应NO+O2+NO2+H2O→HNO3是多组化学计量数的化学方程式,当氧气有$\frac{1}{3}$被NO还原时,此方程式中各物质的化学计量数依次为( )
| A. | 4、9、24、14、28 | B. | 1、1、1、1、2 | C. | 8、9、12、10、20 | D. | 任意比均可 |