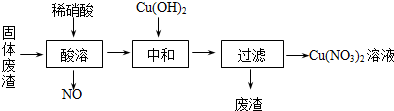
题目内容
9.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: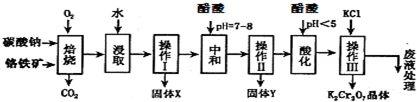
:①4FeO•Cr2O3+8Na2CO3+7O2 $\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 $\stackrel{750℃}{→}$2NaAlO2+CO2↑;
③Cr2CO72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用PH计或PH试纸(填写仪器或试剂名称).
(2)酸化步骤调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:
Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量NaOH溶液(填写试剂)、溶解、过滤、再通入过量二氧化碳(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$(用含m、n的代数式表示).
分析 铬铁矿通过焙烧,生成Na2CrO4、Fe2O3、MgO和NaAlO2的混合体系,然后加水溶解得固体Fe2O3、MgO和溶液Na2CrO4、NaAlO2,再调节溶液的PH,使偏铝酸盐完全沉淀,继续调节溶液的PH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(1)依据流程图和题干反应分析判断固体X的成分;通常PH试纸只能测定溶液PH的整数,测定PH是小数的需要用精确试纸或pH计;
(2)结合流程图和反应过程中得到物质分析,酸化步骤用醋酸调节溶液pH<5为了转化CrO42-离子为Cr2O72-;
(3)溶液中得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤步骤分析回答;
(4)依据物质溶解度比较分析,反应向溶解度晓得方向进行;
(5)利用氢氧化铝是两性氢氧化物和强碱反应溶解,少量镁、铁的难溶化合物不溶解;分离提取溶液中的偏铝酸钠可以根据实验室制取氢氧化铝沉淀的方法进行,通入二氧化碳得到氢氧化铝沉淀;灼烧后得到氧化铝,依据元素守恒计算得到.
解答 解:(1)铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:
①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑;
③Cr2CO72-+H2O?2CrO42-+2H+
操作Ⅰ是过滤得到固体X为Fe2O3、MgO;要检测酸化操作中溶液的pH是否等于4.5,普通pH试纸只能测定溶液pH到整数,是近似测定,准确测定需要用pH计或精确pH试纸,
故答案为:Fe2O3、MgO;pH计或精密pH试纸;
(2)酸化步骤用醋酸调节溶液pH<5,依据流程图中物质的转化和制备目的可知,结合反应平衡Cr2O72-+H2O?2CrO42-+2H+,加入酸,氢离子浓度增大,平衡左移,作用是使CrO42-转化为Cr2O72-,
故答案为:使CrO42-转化为Cr2O72-;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩,冷却结晶、过滤、洗涤、干燥得到晶体,
故答案为:冷却结晶;洗涤;
(4)依据图表物质的溶解度分析对比,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl;说明K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小),
故答案为:K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小);
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是先利用氢氧化铝的两性,用氢氧化钠溶液溶解氢氧化铝过滤得到滤液中通入二氧化碳生成氢氧化铝沉淀,灼烧干燥得到氧化铝干燥固体m g,由铝元素守恒可知,样品中氢氧化铝的质量分数=$\frac{\frac{mg}{156g/mol}×2×78g/mol}{ng}$=$\frac{26m}{17n}$,
故答案为:NaOH溶液;通入过量二氧化碳;$\frac{26m}{17n}$.
点评 本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度中等.

| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 11.2g |
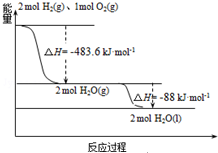 发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:(1)H2(g)═H2(l)△H1=-0.92kJ•mol-1
(2)O2(g)═O2(l)△H2=-6.84kJ•mol-1
下列说法正确的是( )
| A. | H2(g)与O2(g)反应生成H2O(g)放热483.6kJ•mol-1 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)═2H2O(g)△H=-474.92kJ•mol-1 | |
| D. | H2O(g)=H2O(l)△H=-88kJ•mol-1 |
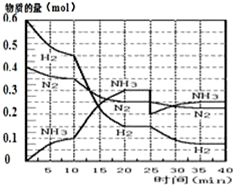 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{(\frac{0.25mol}{2L})(\frac{0.15mol}{2L})^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1530kJ•mol-1.

| A. | 该物质分子式为C7H10O5 | |
| B. | 该物质与乙酸互为同系物 | |
| C. | 该物质能与乙醇发生酯化反应 | |
| D. | 1 mol该物质与Na反应时,最多消耗Na 4 mol |
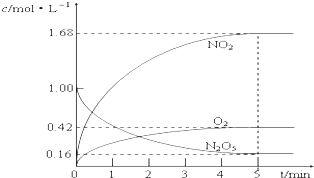 (1)该反应的化学方程式为2N2O5?4NO2+O2
(1)该反应的化学方程式为2N2O5?4NO2+O2 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则: