题目内容
【题目】铋(Bi)是一种稀有金属,目前世界年产量约4000t左右。铋的主要用途是制造易熔合金,作为冶金添加剂及制药工业等方面。铋的冶炼分为粗炼和精炼两个阶段:
Ⅰ.粗炼
辉铋矿(Bi2S3) | 铋华(Bi2O3) | 混合精矿(Bi2S3/ Bi2O3) |
沉淀熔炼 | 还原熔炼 | 混合熔炼 |
Ⅱ.精炼
![]()
回答下列问题:
(1)铋在元素周期表中的位置是_______________。
(2)①还原熔炼法中还需加入一定量造渣剂(纯碱)使其与矿石中的脉石(主要为Al2O3)形成熔渣,写出形成熔渣反应的化学反应方程式______________________________。
②对于混合精矿,矿料中的Bi2S3和Bi2O3可在高温下彼此进行氧化还原反应生产粗铋,写出此反应的化学反应方程式______________________________。
③有些硫化铋矿也可用湿法处理,即加入三氯化铁与盐酸的混合液,可溶解硫化铋和少量天然铋,这是利用了_______________________________。
(3)电解精炼时,以_______作为阳极,__________作为阴极,电解液一般用FeCl3/HCl。此时电解出的铋还含有砷、锑、碲杂质,需进一步除去:
①除砷、锑

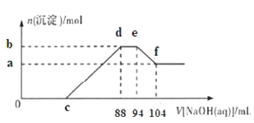
在熔融粗铋中通入空气,砷、锑将优先氧化为As2O3及Sb2O3,根据上图分析其原因是________________________________。
②除碲:向除砷、锑后的熔铋中继续鼓入空气并加入NaOH,杂质碲被氧化为TeO2随即被NaOH吸入形成亚碲酸钠,写出吸入反应的离子反应方程式_______________________。
【答案】第六周期ⅤA族 Al2O3+ Na2CO3![]() 2NaAlO2+CO2↑ Bi2S3+Bi2O3
2NaAlO2+CO2↑ Bi2S3+Bi2O3![]() 6Bi+3SO2↑ 三氯化铁有氧化性(其他合理答案) 粗铋 精铋 相同温度下,生成此两种氧化物的反应更有利于自发进行(其他合理答案也给分)
6Bi+3SO2↑ 三氯化铁有氧化性(其他合理答案) 粗铋 精铋 相同温度下,生成此两种氧化物的反应更有利于自发进行(其他合理答案也给分) ![]()
【解析】
(3)电解精炼时,需要被提纯的金属作为阳极被氧化成阳离子,再在阴极被还原以达到精炼的目的;
①根据△G=△H-T△S<0时反应可以自发进行进行分析;
②Te与S元素同主族,亚碲酸根应为TeO![]() 。
。
(1)Bi元素为83号元素,与N、P等元素同主族,位于元素周期表第六周期VA族;
(2)①Al2O3是两性氧化物,与纯碱(Na2CO3)反应时应表现酸性,参考二氧化硅和碳酸钠的反应可知该反应生成偏铝酸钠和二氧化碳,根据元素守恒可得化学方程式为Al2O3+ Na2CO3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
②Bi2S3和Bi2O3可在高温彼此进行氧化还原反应生产粗铋,结合元素守恒和价态规律,可知还会生成SO2,所以化学反应方程式为Bi2S3+Bi2O3![]() 6Bi+3SO2↑;
6Bi+3SO2↑;
③三氯化铁有氧化性,可以氧化硫化铋中的S元素,使其溶解;
(3)电解精炼时,需要将Bi3+还原以得到精铋,电解池中阴极发生还原反应,所以精铋作为阴极,同时粗铋作为阳极,被氧化成阳离子,再在阴极被还原以达到精炼的目的;
①△G=△H-T△S<0时反应可以自发,越小越容易自发进行,据图可知相同温度下,生成此两种氧化物的反应更有利于自发进行;
②参考SO2和NaOH的反应可知TeO2别NaOH吸入的反应方程式为![]() 。
。

 阅读快车系列答案
阅读快车系列答案