题目内容
【题目】如图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度为___mol/L。
(2)某化学小组进行硫酸酸性实验探究时,需要240mL4.6mol/L的稀硫酸,则需要取上述的浓硫酸___mL。
(3)在配制4.6mol/L稀硫酸的过程中,下列情况对所配制硫酸溶液物质的量浓度有何影响(填偏高偏低或无影响)?
①未经冷却趁热将溶液注入容量瓶中:___;
②定容时仰视读数:___;
③用量筒量取浓硫酸时俯视___;
④移液时不慎将少量溶液滴在容量瓶外面:___。
(4)实验过程中出现下列情况应如何处理?
①向容量瓶中加入蒸馏水至距刻度线1~2cm时,应___;
②加蒸馏水时不慎超过了刻度,应___。
【答案】18.4 62.5 偏高 偏低 偏低 偏低 该用胶头滴管滴加 重新配制
【解析】
(1)根据![]() 计算溶液的浓度;
计算溶液的浓度;
(2)实验室没有240mL容量瓶,实验中应用250mL容量瓶,计算时,也用250mL;
(3)根据![]() 进行误差分析。
进行误差分析。
(1)由标签可知,该硫酸质量分数为![]() ,密度为
,密度为![]() ,故该硫酸的物质的量浓度
,故该硫酸的物质的量浓度![]() ,故答案为:
,故答案为:![]() ;
;
(2)需要由浓硫酸配制240mL 4.6mol·L-1的稀硫酸,实验室没有240mL容量瓶,实验中应用250mL容量瓶,计算时,也用250mL。设需要浓硫酸体积为V,根据稀释定律,![]() ,解得
,解得![]() ;故答案为:
;故答案为:![]() ;
;
(3)根据![]() 进行误差分析; ①未经冷却趁热将溶液注入容量瓶中,导致V偏小,因此c偏高,故答案为:偏高;
进行误差分析; ①未经冷却趁热将溶液注入容量瓶中,导致V偏小,因此c偏高,故答案为:偏高;
![]() 定容时仰视读数,导致V偏大,则c偏低,故答案为:偏低;
定容时仰视读数,导致V偏大,则c偏低,故答案为:偏低;
![]() 用量筒量取浓硫酸时俯视,导致n偏小,则c偏低,故答案为:偏低;
用量筒量取浓硫酸时俯视,导致n偏小,则c偏低,故答案为:偏低;
![]() 移液时不慎将少量溶液滴在容量瓶外面,导致n偏小,则c偏低,故答案为:偏低;
移液时不慎将少量溶液滴在容量瓶外面,导致n偏小,则c偏低,故答案为:偏低;
(4) ①向容量瓶中加入蒸馏水至距刻度线![]() 时,应该用胶头滴管滴加,故答案为:该用胶头滴管滴加;
时,应该用胶头滴管滴加,故答案为:该用胶头滴管滴加;
![]() 加蒸馏水时不慎超过了刻度,导致c偏小,应重新配制,故答案为:重新配制。
加蒸馏水时不慎超过了刻度,导致c偏小,应重新配制,故答案为:重新配制。

【题目】铋(Bi)是一种稀有金属,目前世界年产量约4000t左右。铋的主要用途是制造易熔合金,作为冶金添加剂及制药工业等方面。铋的冶炼分为粗炼和精炼两个阶段:
Ⅰ.粗炼
辉铋矿(Bi2S3) | 铋华(Bi2O3) | 混合精矿(Bi2S3/ Bi2O3) |
沉淀熔炼 | 还原熔炼 | 混合熔炼 |
Ⅱ.精炼
![]()
回答下列问题:
(1)铋在元素周期表中的位置是_______________。
(2)①还原熔炼法中还需加入一定量造渣剂(纯碱)使其与矿石中的脉石(主要为Al2O3)形成熔渣,写出形成熔渣反应的化学反应方程式______________________________。
②对于混合精矿,矿料中的Bi2S3和Bi2O3可在高温下彼此进行氧化还原反应生产粗铋,写出此反应的化学反应方程式______________________________。
③有些硫化铋矿也可用湿法处理,即加入三氯化铁与盐酸的混合液,可溶解硫化铋和少量天然铋,这是利用了_______________________________。
(3)电解精炼时,以_______作为阳极,__________作为阴极,电解液一般用FeCl3/HCl。此时电解出的铋还含有砷、锑、碲杂质,需进一步除去:
①除砷、锑
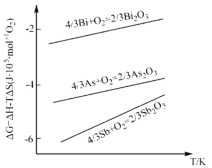
在熔融粗铋中通入空气,砷、锑将优先氧化为As2O3及Sb2O3,根据上图分析其原因是________________________________。
②除碲:向除砷、锑后的熔铋中继续鼓入空气并加入NaOH,杂质碲被氧化为TeO2随即被NaOH吸入形成亚碲酸钠,写出吸入反应的离子反应方程式_______________________。
【题目】已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
A. 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B. 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
C. NaCN中通入少量CO2发生的化学反应为:NaCN+CO2+H2O=HCN+NaHCO3
D. 稀释HCN溶液过程中,![]() 减小
减小




