题目内容
【题目】相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
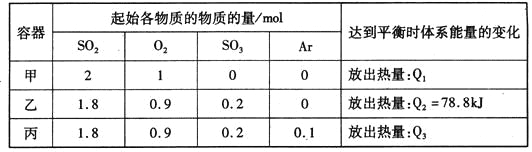
下列叙述正确的是
A. Q1>Q3>Q2=78.8kJ
B. 三个容器中反应的平衡常数均为K=2
C. 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D. 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=![]() mol/(L·min)
mol/(L·min)
【答案】D
【解析】
乙、丙转化到左边,SO2、O2的物质的量分别为2mol、1mol,与甲中SO2、O2的物质的量对应相等,恒温恒容条件下,丙中Ar不影响平衡移动,故三者为完全等效平衡,平衡时SO2、O2、SO3的物质的量对应相等。
A.由于平衡时二氧化硫物质的量相等,故参加反应二氧化硫的物质的量:甲>乙=丙,故放出热量:Q1>Q3=Q2=78.8kJ,故A错误;
B.甲、乙、丙三容器温度相同,平衡常数相同,乙中平衡时放出热量为78.8kJ,由2SO2(g)+O2(g)![]() 2SO3(g)△H=-197kJmol-1可知,参加反应的二氧化硫为2mol×
2SO3(g)△H=-197kJmol-1可知,参加反应的二氧化硫为2mol×![]() =0.8mol,则二氧化硫浓度变化量为
=0.8mol,则二氧化硫浓度变化量为![]() =0.4mol/L,SO2、O2、SO3的起始浓度分别为
=0.4mol/L,SO2、O2、SO3的起始浓度分别为![]() =0.9mol/L、
=0.9mol/L、![]() =0.45mol/L、
=0.45mol/L、![]() =0.1mol/L,则:
=0.1mol/L,则:
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始(mol/L):0.9 0.45 0.1
转化(mol/L):0.4 0.2 0.4
平衡(mol/L):0.5 0.25 0.5
故平衡常数K=![]() =4,故B错误;
=4,故B错误;
C.乙中平衡时二氧化硫物质的量为1.8mol-0.8mol=1mol,甲中参加反应二氧化硫为2mol-1mol=1mol,甲中二氧化硫的转化率![]() ×100%=50%,正反应为放热反应,升高温度平衡向逆反应方向移动,SO2的转化率将小于50%,故C错误;
×100%=50%,正反应为放热反应,升高温度平衡向逆反应方向移动,SO2的转化率将小于50%,故C错误;
D.乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=![]() =
=![]() mol/(Lmin),故D正确;
mol/(Lmin),故D正确;
故选D。
【点晴】
本题考查等效平衡、化学平衡计算、化学平衡常数计算、化学反应速率计算、化学平衡影响因素等,关键是理解等效平衡规律,注意丙中稀有气体在恒温恒容条件下不影响平衡移动。

【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
【题目】铋(Bi)是一种稀有金属,目前世界年产量约4000t左右。铋的主要用途是制造易熔合金,作为冶金添加剂及制药工业等方面。铋的冶炼分为粗炼和精炼两个阶段:
Ⅰ.粗炼
辉铋矿(Bi2S3) | 铋华(Bi2O3) | 混合精矿(Bi2S3/ Bi2O3) |
沉淀熔炼 | 还原熔炼 | 混合熔炼 |
Ⅱ.精炼
![]()
回答下列问题:
(1)铋在元素周期表中的位置是_______________。
(2)①还原熔炼法中还需加入一定量造渣剂(纯碱)使其与矿石中的脉石(主要为Al2O3)形成熔渣,写出形成熔渣反应的化学反应方程式______________________________。
②对于混合精矿,矿料中的Bi2S3和Bi2O3可在高温下彼此进行氧化还原反应生产粗铋,写出此反应的化学反应方程式______________________________。
③有些硫化铋矿也可用湿法处理,即加入三氯化铁与盐酸的混合液,可溶解硫化铋和少量天然铋,这是利用了_______________________________。
(3)电解精炼时,以_______作为阳极,__________作为阴极,电解液一般用FeCl3/HCl。此时电解出的铋还含有砷、锑、碲杂质,需进一步除去:
①除砷、锑

在熔融粗铋中通入空气,砷、锑将优先氧化为As2O3及Sb2O3,根据上图分析其原因是________________________________。
②除碲:向除砷、锑后的熔铋中继续鼓入空气并加入NaOH,杂质碲被氧化为TeO2随即被NaOH吸入形成亚碲酸钠,写出吸入反应的离子反应方程式_______________________。