题目内容
【题目】实验研究发现,金属与硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与足量很稀的硝酸充分反应,反应过程中无气体放出,在反应结束后的溶液中逐滴加入5mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
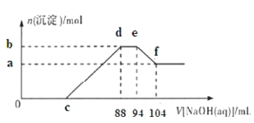
A.硝酸的还原产物全部是![]() B.b点与a点的差值为0.05mol
B.b点与a点的差值为0.05mol
C.原硝酸溶液中硝酸的物质的量为0.47molD.样品中铝粉和铁粉的物质的之比为5:3
【答案】C
【解析】
0c段没有沉淀生成,说明硝酸过量,发生反应:H++OHˉ=H2O,可知金属与酸反应中Al、Fe被氧化为Al3+、Fe3+;
cd段产生沉淀,发生反应:Fe3++3OHˉ=Fe(OH)3↓,Al3++3OHˉ=Al(OH)3↓;
de段消耗NaOH,但沉淀量不变,而金属与硝酸反应过程中无气体放出,由题意可知N元素被还原为![]() ,发生反应:
,发生反应:![]() +OHˉ=NH3H2O;
+OHˉ=NH3H2O;
ef段沉淀部分溶解,发生反应:Al(OH)3+ OHˉ=AlO![]() +2H2O。
+2H2O。
A.根据题目信息可知硝酸氧化金属单质时没有气体放出,所以硝酸的还原产物全部是铵根,故A正确;
B.b与a的差值为氢氧化铝的物质的量,由图可知,ef段消耗的氢氧化钠溶液为104mL-94mL=10mL,故该阶段参加反应的氢氧化钠为0.01L×5mol/L=0.05mol,根据Al(OH)3+ OHˉ= AlO![]() +2H2O可知Al(OH)3的物质的量为0.05mol,故B正确;
+2H2O可知Al(OH)3的物质的量为0.05mol,故B正确;
C.由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵。由图可知,de段消耗的氢氧化钠的体积为94mL-88mL=6mL,故该阶段参加反应的氢氧化钠为0.006L×5mol/L=0.03mol,根据![]() + OHˉ=NH3H2O 可知溶液中n(
+ OHˉ=NH3H2O 可知溶液中n(![]() )=0.03ml,由N原子守恒可知n(NH4NO3)=n(
)=0.03ml,由N原子守恒可知n(NH4NO3)=n(![]() )=0.03mol,根据钠元素守恒可知n(NaNO3)=n(NaOH)=0.088L×5mol/L=0.44mol,根据氮元素守恒原硝酸溶液中n(HNO3)=n(NaNO3)+2n(NH4NO3)=0.44mol+0.03mol×2=0.5mol,故C错误;
)=0.03mol,根据钠元素守恒可知n(NaNO3)=n(NaOH)=0.088L×5mol/L=0.44mol,根据氮元素守恒原硝酸溶液中n(HNO3)=n(NaNO3)+2n(NH4NO3)=0.44mol+0.03mol×2=0.5mol,故C错误;
D.由Al原子守恒可知n(Al)=n[Al(OH)3]=0.05mol,根据电子转移守恒有:3n(Fe)+3n(Al)=8n(![]() ),即3n(Fe)+3×0.05mol=8×0.03mol,解得n(Fe)=0.03mol,故n(Al):n(Fe)=0.05mol:0.03mol=5:3,故D正确;
),即3n(Fe)+3×0.05mol=8×0.03mol,解得n(Fe)=0.03mol,故n(Al):n(Fe)=0.05mol:0.03mol=5:3,故D正确;
故答案为C。

【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
【题目】铋(Bi)是一种稀有金属,目前世界年产量约4000t左右。铋的主要用途是制造易熔合金,作为冶金添加剂及制药工业等方面。铋的冶炼分为粗炼和精炼两个阶段:
Ⅰ.粗炼
辉铋矿(Bi2S3) | 铋华(Bi2O3) | 混合精矿(Bi2S3/ Bi2O3) |
沉淀熔炼 | 还原熔炼 | 混合熔炼 |
Ⅱ.精炼
![]()
回答下列问题:
(1)铋在元素周期表中的位置是_______________。
(2)①还原熔炼法中还需加入一定量造渣剂(纯碱)使其与矿石中的脉石(主要为Al2O3)形成熔渣,写出形成熔渣反应的化学反应方程式______________________________。
②对于混合精矿,矿料中的Bi2S3和Bi2O3可在高温下彼此进行氧化还原反应生产粗铋,写出此反应的化学反应方程式______________________________。
③有些硫化铋矿也可用湿法处理,即加入三氯化铁与盐酸的混合液,可溶解硫化铋和少量天然铋,这是利用了_______________________________。
(3)电解精炼时,以_______作为阳极,__________作为阴极,电解液一般用FeCl3/HCl。此时电解出的铋还含有砷、锑、碲杂质,需进一步除去:
①除砷、锑
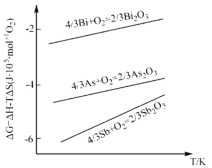
在熔融粗铋中通入空气,砷、锑将优先氧化为As2O3及Sb2O3,根据上图分析其原因是________________________________。
②除碲:向除砷、锑后的熔铋中继续鼓入空气并加入NaOH,杂质碲被氧化为TeO2随即被NaOH吸入形成亚碲酸钠,写出吸入反应的离子反应方程式_______________________。