题目内容
18.设NA 为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 88.0g 干冰中含有的电子数为8.0NA | |
| B. | 常温下,11.2L乙烯在氧气中完全燃烧转移的电子数为6.0NA | |
| C. | 常温下1.0L0.1 mol•L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA | |
| D. | 1.2g金刚石中含有的碳碳键数为0.4NA |
分析 A、求出干冰的物质的量,然后根据1mol干冰中含22mol电子来分析;
B、常温下,气体摩尔体积大于22.4L/mol;
C、根据溶液的电荷守恒来分析;
D、求出金刚石的物质的量,然后根据1mol金刚石中含2mol碳碳键来分析.
解答 解:A、88g干冰的物质的量为2mol,而1mol干冰中含22mol电子,故2mol干冰中含44mol电子即44NA个,故A错误;
B、常温下,气体摩尔体积大于22.4L/mol,故11.2L乙烯的物质的量小于0.5mol,故完全燃烧转移的电子数小于6NA个,故B错误;
C、根据溶液的电荷守恒可知:n(NH4+)+n(H+)=n(OH-)+n(Cl-),由于溶液中的n(Cl-)=CV=0.1mol/L×1L=0.1mol,故溶液中的n(NH4+)和n(H+)大于0.1mol,则个数之和大于0.1NA个,故C正确;
D、1.2g金刚石的物质的量为0.1mol,而1mol金刚石中含2mol碳碳键,故0.1mol金刚石中含0.2mol碳碳键即0.2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
9.乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)25℃时,K=2.95×1011①
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022②
(1)写出反应①的平衡常数表达式K=$\frac{c({C}_{2}{H}_{5}OH)•{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}$.
(2)条件相同时,反应①与反应②相比,转化程度更大的是②.
(3)在一定压强下,测得反应①的实验数据如表.
根据表中数据分析:
①温度升高,K值减小(填“增大”、“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值不变(填“增大”、“减小”或“不变”),对生成乙醇有利(填“有利”或“不利”).
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)25℃时,K=2.95×1011①
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022②
(1)写出反应①的平衡常数表达式K=$\frac{c({C}_{2}{H}_{5}OH)•{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}$.
(2)条件相同时,反应①与反应②相比,转化程度更大的是②.
(3)在一定压强下,测得反应①的实验数据如表.
根据表中数据分析:
| 温度(K)CO2 转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
②提高氢碳比[n(H2)/n(CO2)],K值不变(填“增大”、“减小”或“不变”),对生成乙醇有利(填“有利”或“不利”).
3. 已知25℃时有关弱酸的电离平衡常数:
已知25℃时有关弱酸的电离平衡常数:
(1)同温度下,等pH值的a.NaHCO3 b.NaCN c.Na2CO3溶液的物质的量浓度由大到小的顺序为a>b>c(填序号).
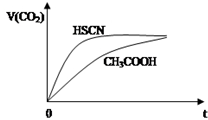
(2)25℃时,将20mL 0.1mol•L-1CH3COOH溶液和20mL 0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快.反应结束后所得两溶液中,c(SCN-)>c(CH3COO-)(填“>”、“<”或“=”)
(3)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数.
 已知25℃时有关弱酸的电离平衡常数:
已知25℃时有关弱酸的电离平衡常数:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(2)25℃时,将20mL 0.1mol•L-1CH3COOH溶液和20mL 0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快.反应结束后所得两溶液中,c(SCN-)>c(CH3COO-)(填“>”、“<”或“=”)
(3)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数.
10.在硫酸溶液中,NaClO3和Na2SO3能按物质的量之比l:2完全反应,生成一种棕黄色气体X,同时Na2SO3被氧化为Na2SO4,则X为( )
| A. | Cl2 | B. | Cl2O | C. | ClO2 | D. | Cl2O7 |
7.某溶液含有K+、Fe3+、SO$\stackrel{2-}{4}$、OH-、I-中的几种.取样,滴加KSCN溶液后显红色.为确定该溶液的组成,还需检验的离子是( )
| A. | K+ | B. | I- | C. | SO$\stackrel{2-}{4}$ | D. | CO$\stackrel{2-}{3}$ |
8.下列各离子浓度的大小比较,正确的是( )
| A. | 同浓度的下列溶液中:①(NH4)2Fe(SO4)2②(NH4)2CO3③(NH4)2SO4,c(NH+4)由大到小的顺序是:①>③>② | |
| B. | 常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH4+)>c(Cl-) | |
| C. | 0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| D. | 0.1mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |


