题目内容
按要求填空.
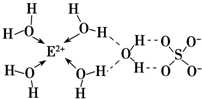
(1)E的一种核素的质量数为63,中子数为34.E的基态原子的核外电子排布式是 基态E2+的核外电子排布式为 E的某种化合物的结构如右图所示.微粒间的相互作用包括化学键和分子间作用力,此化合物中各种粒子间的相互作用力有
(2)Se的基态原子价电子轨道表示式是 ;Mn2+离子的电子排布式 ;CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C.Si.H的电负性由大到小的顺序为 .
(3)请写出与N元素的单质互为等电子体的分子.离子的化学式 、 (各写一种)
(4)氧元素与多种元素具有亲和力,所以形成化合物的种类很多①氧元素与氟元素能形成OF2分子,该分子的空间构型为 ②根据等电子原理,在NO2+离子中氮原子轨道杂化类型是 ;1molO22+中含有的π键数目为
(5)科学家把NaNO3和Na2O在一定条件下反应,得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各种原子的最外层电子都满足8电子稳定结构.该阴离子的电子式是 .
(1)E的一种核素的质量数为63,中子数为34.E的基态原子的核外电子排布式是

(2)Se的基态原子价电子轨道表示式是
(3)请写出与N元素的单质互为等电子体的分子.离子的化学式
(4)氧元素与多种元素具有亲和力,所以形成化合物的种类很多①氧元素与氟元素能形成OF2分子,该分子的空间构型为
(5)科学家把NaNO3和Na2O在一定条件下反应,得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各种原子的最外层电子都满足8电子稳定结构.该阴离子的电子式是
考点:原子核外电子排布,元素电离能、电负性的含义及应用,“等电子原理”的应用,原子轨道杂化方式及杂化类型判断,含有氢键的物质
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)E的一种核素的质量数为63,中子数为34,质子数=63-34=29,为Cu,然后根据构造原理和洪特规则特例写出核外电子排布式,变为离子时失去4s上的电子然后失去3d上的电子;根据结构式中所含化学键、氢键判断微粒含有的作用力;
(2)Se的价电子排布式为4s24p4,Mn的原子序数为25,根据能量最低原理可写出Mn的基态原子的电子排布式,进而可确定Mn2+基态的电子排布式;分子中共用电子对偏向于电负性大的原子,偏离于电负性小的原子;
(3)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征;
(4)由价层电子对互斥理论可知,OF2分子的空间构型为V形,价电子数和原子数分别都相等的是等电子体,则与NO2+离子互为等电子体的是CO2,CO2是含有双键的直线形结构,所以根据等电子原理,在NO2+离子中氮原子轨道杂化类型是sp杂化;与O22+离子互为等电子体的是氮气,氮气含有三键,而三键是由1个σ键和2个π键构成的,则1 mol O22+中含有的π键数目为2NA;
(5)原子个数相等价电子数相等的微粒属于等电子体,且等电子体结构相似,阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构,则该离子是NO4 3-.
(2)Se的价电子排布式为4s24p4,Mn的原子序数为25,根据能量最低原理可写出Mn的基态原子的电子排布式,进而可确定Mn2+基态的电子排布式;分子中共用电子对偏向于电负性大的原子,偏离于电负性小的原子;
(3)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征;
(4)由价层电子对互斥理论可知,OF2分子的空间构型为V形,价电子数和原子数分别都相等的是等电子体,则与NO2+离子互为等电子体的是CO2,CO2是含有双键的直线形结构,所以根据等电子原理,在NO2+离子中氮原子轨道杂化类型是sp杂化;与O22+离子互为等电子体的是氮气,氮气含有三键,而三键是由1个σ键和2个π键构成的,则1 mol O22+中含有的π键数目为2NA;
(5)原子个数相等价电子数相等的微粒属于等电子体,且等电子体结构相似,阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构,则该离子是NO4 3-.
解答:
解:(1)E的一种核素的质量数为63,中子数为34,质子数=63-34=29,为Cu,3d达到全满,原子核外电子排布式为1s22s22p63s23p63d104s1,变为离子时失去4s上的电子然后失去3d上的电子,基态Cu2+的核外电子排布式为1s22s22p63s23p63d9,水分子做配体,Cu2+为中心离子,因此存在配位键,O-H、S-O为共价键,配离子与硫酸根离子间形成离子键,水分子与水分子间形成氢键,
故答案为:1s22s22p63s23p63d104s1;1s22s22p63s23p63d9; 配位键、氢键、离子键、共价键;
(2)Se的价电子排布式为4s24p4,基态原子价电子轨道表示式 ,Mn的原子序数为25,基态原子的电子排布式为,1s22s22p63s23p63d54s2,则Mn2+基态的电子排布式可表示为1s22s22p63s23p63d5(或[Ar]3d5),元素的电负性越大,其吸引电子能力越大,根据元素吸引电子能力知,这三种元素电负性大小顺序是C>H>Si,
,Mn的原子序数为25,基态原子的电子排布式为,1s22s22p63s23p63d54s2,则Mn2+基态的电子排布式可表示为1s22s22p63s23p63d5(或[Ar]3d5),元素的电负性越大,其吸引电子能力越大,根据元素吸引电子能力知,这三种元素电负性大小顺序是C>H>Si,
故答案为: ;1s22s22p63s23p63d5(或[Ar]3d5);C>H>Si;
;1s22s22p63s23p63d5(或[Ar]3d5);C>H>Si;
(3)N2有2个原子,14个电子(或10个价电子),其等电子体为CO、CN-、C22- 等,故答案为:CO、C22-;
(4)由价层电子对互斥理论可知,OF2分子中中心原子O的价层电子对数为2+
(6-2×1)=4,含有两个孤电子对,空间构型为V形,价电子数和原子数分别都相等的是等电子体,则与NO2+离子互为等电子体的是CO2.CO2是含有双键的直线形结构,所以根据等电子原理,在NO2+离子中氮原子轨道杂化类型是sp杂化;与O22+离子互为等电子体的是氮气.氮气含有三键,而三键是由1个σ键和2个π键构成的,则1 mol O22+中含有的π键数目为2NA,
故答案为:V形;sp; 2NA;
(5)原子个数相等价电子数相等的微粒属于等电子体,且等电子体结构相似,阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构,则该离子是NO4 3-,其电子式为: ,故答案为:
,故答案为: .
.
故答案为:1s22s22p63s23p63d104s1;1s22s22p63s23p63d9; 配位键、氢键、离子键、共价键;
(2)Se的价电子排布式为4s24p4,基态原子价电子轨道表示式
 ,Mn的原子序数为25,基态原子的电子排布式为,1s22s22p63s23p63d54s2,则Mn2+基态的电子排布式可表示为1s22s22p63s23p63d5(或[Ar]3d5),元素的电负性越大,其吸引电子能力越大,根据元素吸引电子能力知,这三种元素电负性大小顺序是C>H>Si,
,Mn的原子序数为25,基态原子的电子排布式为,1s22s22p63s23p63d54s2,则Mn2+基态的电子排布式可表示为1s22s22p63s23p63d5(或[Ar]3d5),元素的电负性越大,其吸引电子能力越大,根据元素吸引电子能力知,这三种元素电负性大小顺序是C>H>Si,故答案为:
 ;1s22s22p63s23p63d5(或[Ar]3d5);C>H>Si;
;1s22s22p63s23p63d5(或[Ar]3d5);C>H>Si;(3)N2有2个原子,14个电子(或10个价电子),其等电子体为CO、CN-、C22- 等,故答案为:CO、C22-;
(4)由价层电子对互斥理论可知,OF2分子中中心原子O的价层电子对数为2+
| 1 |
| 2 |
故答案为:V形;sp; 2NA;
(5)原子个数相等价电子数相等的微粒属于等电子体,且等电子体结构相似,阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构,则该离子是NO4 3-,其电子式为:
 ,故答案为:
,故答案为: .
.
点评:本题考查等电子体、核外电子排布式、杂化轨道类型、化学键和氢键配合物的结构等知识,该题是高考中的常见题型,属于中等难度的试题.试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、64gSO2中含有的氧原子数为2NA |
| B、同温同压下,相同体积的任何气体所含原子个数相同 |
| C、40gNaOH溶解在1L水中,所制得的溶液,物质的量浓度为1mol?L-1 |
| D、标准状况下,11.2LH2O含有的电子数为5NA |
NaNO2是一种食品添加剂,它能致癌,酸性KMnO4溶液与NaNO2反应的离子方程式为MnO4-+NO2-+H+-Mn2++□+H2O (未配平).下列叙述正确的是( )
| A、反应后溶液pH下降 |
| B、通常用盐酸酸化的高锰酸钾溶液 |
| C、方框中粒子为NO2 |
| D、当生成1 mol Mn2+ 需消耗2.5 mol NO2- |
下列电子排布图中,属于基态碳的是( )
A、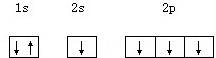 |
B、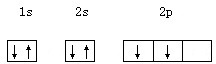 |
C、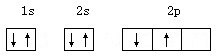 |
D、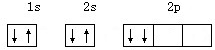 |
下列各原子轨道中能容纳电子数最多的是( )
| A、5p | B、6s | C、4f | D、4d |
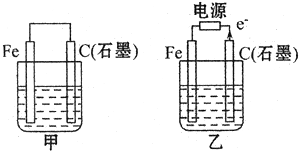 (1)若甲、乙两烧杯中均盛有饱和NaCI溶液.
(1)若甲、乙两烧杯中均盛有饱和NaCI溶液. 氮元素可以形成多种化合物.
氮元素可以形成多种化合物.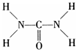 ,则尿素分子中C和N原子的杂化方式分别是
,则尿素分子中C和N原子的杂化方式分别是