题目内容
 氮元素可以形成多种化合物.
氮元素可以形成多种化合物.(1)基态氮原子的价电子轨道表示式是
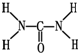
(2)已知尿素的结构式为
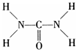 ,则尿素分子中C和N原子的杂化方式分别是
,则尿素分子中C和N原子的杂化方式分别是(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮化物.
①NH3分子的空间构型是
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g),△H=-1038.7kJ?mol-1当肼燃烧放出519.35kJ热量时,形成的π键有
考点:原子核外电子排布,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断,反应热和焓变
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)N原子核外有7个电子,最外层有5个电子,根据原子轨道中电子的填充规则画出其价电子排布图;
(2)由尿素的结构式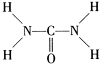 可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;
可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;
(3)①根据价层电子对互斥理论确定分子空间构型;
②根据燃烧放出519.35kJ热量求出N2的物质的量,1molN2中含有2molπ键.
(2)由尿素的结构式
 可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;
可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;(3)①根据价层电子对互斥理论确定分子空间构型;
②根据燃烧放出519.35kJ热量求出N2的物质的量,1molN2中含有2molπ键.
解答:
解:(1)N原子核外有7个电子,最外层有5个电子,电子排布式1s22s22p3,其价层电子排布图为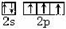 ,故答案为:
,故答案为: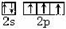 ;
;
(2)由尿素分子的结构式 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,
故答案为:sp2、sp3;
(3)①NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥形,故答案为:三角锥形:
②由热化学方程式可知,当肼燃烧放出519.35kJ热量时,生成1.5mol氮气,1molN2中含有2molπ键,所以1.5 molN2中含有3molπ键,故答案为:3.
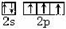 ,故答案为:
,故答案为: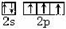 ;
;(2)由尿素分子的结构式
 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2、sp3;
(3)①NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥形,故答案为:三角锥形:
②由热化学方程式可知,当肼燃烧放出519.35kJ热量时,生成1.5mol氮气,1molN2中含有2molπ键,所以1.5 molN2中含有3molπ键,故答案为:3.
点评:本题考查了电子排布图、分子空间构型的判断、原子的杂化方式的判断等知识点,题目涉及的知识点较多,综合性较强,难度中等,注意分子空间构型的判断及原子杂化方式的判断是高考的热点.

练习册系列答案
相关题目
某澄清溶液可能含有K+、Al3+、Mg2+、NH4+、Fe2+、Fe3+、Cu2+、SO42-、CO32-中的一种或几种,为确定其成分,进行如下实验:①取部分溶液,逐滴滴入用HCl酸化的BaCl2溶液,只产生白色沉淀;②另取部分溶液,缓慢加入足量的Na2O2固体并加热,产生无色无味的气体,同时产生白色沉淀后白色沉淀部分溶解.下列推断正确的是( )
| A、肯定有Al3+、SO42-,可能有K+、NH4+ |
| B、肯定无Fe2+、Mg2+、CO32-,可能有Al3+ |
| C、原溶液一定是明矾和MgSO4的混合溶液 |
| D、不能确定的离子只能通过焰色反应来确定 |
科学研究证明:核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子数目及核电荷数有关.氩原子与硫离子的核外电子排布相同,1s22s22p63s23p6.下列说法正确的是( )
| A、两粒子的1s能级上的电子能量相同 |
| B、两粒子的3p能级上的电子离核的距离相同 |
| C、两粒子的电子发生跃迁时,产生的光谱不同 |
| D、两粒子都达8电子稳定结构,化学性质相同 |