题目内容
浓度均为0.1mol?L-1的五种溶液:①CH3COOH ②NaOH ③CH3COONa ④Ba(OH)2 ⑤Na2CO3中,由水电离出的c(OH-)由小到大的顺序正确的是( )
| A、④②③①⑤ |
| B、②④①⑤③ |
| C、①③⑤②④ |
| D、④②①③⑤ |
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较pH.
解答:
醋酸为酸,氢氧化钡和氢氧化钠为碱,氢氧化钡为二元碱,氢氧根离子浓度大于氢氧化钠,碳酸钠与醋酸钠为强碱弱酸盐,水解导致其溶液呈碱性,醋酸的酸性强于碳酸,碳酸钠水解程度强于醋酸钠,碳酸钠溶液中氢氧根离子浓度大于醋酸钠,醋酸为酸,氢氧根离子浓度最小,则这几种溶液中氢氧根离子浓度由小到大的顺序为:①③⑤②④,故选C.
点评:本题通过比较氢氧根离子浓度的大小,考查了盐类水解.电解质的电离等知识,题目难度不大.

练习册系列答案
相关题目
将1mol某饱和醇分成两等份.其中一份充分燃烧后生成1.5mol CO2,另一份与足量钠反应生成5.6L H2(标准状况).这种醇分子结构中除羟基外,还有两种不同的氢原子.则这种醇是( )
| A、CH3CH(OH)CH3 |
| B、CH2(OH)CH(OH)CH3 |
| C、CH3CH2CH2OH |
| D、CH3CH2OH |
在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的物质的量增加了1mol,则有关该反应的速率正确的是( )
| A、υ(H2)=0.15 mol/(L?min) |
| B、υ(N2)=0.2mol/(L?min) |
| C、υ(N2)=0.1 mol/(L?min) |
| D、υ (NH3)=0.2mol/(L?min) |
24mL浓度为0.05mol/L的Na2SO3溶液恰好与20mL某浓度的K2Cr2O7溶液完全反应.已知Na2SO3被K2Cr2O7氧化为Na2SO4,且元素Cr在还原产物中的化合价为+3价,则原K2Cr2O7溶液的物质的量浓度为( )
| A、0.01mol/L |
| B、0.02mol/L |
| C、0.03mol/L |
| D、0.04mol/L |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol S在足量O2中燃烧,转移的电子数为6 NA |
| B、标况下,22.4L氦气含有的原子数为2NA |
| C、28 g C2H4中含有2 NA个碳原子 |
| D、0.1 mol?L-1的碳酸氢钠溶液中含钠离子数为0.1NA |
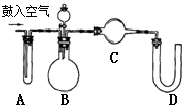 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.