题目内容
能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
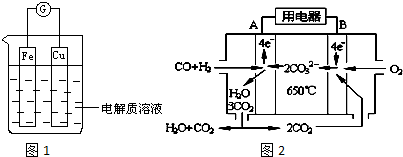
(1)如图1所示,组成一个原电池.
①当电解质溶液为稀硫酸时:Cu电极是 (填“正”或“负”)极,其电极反应为 ;
②当电解质溶液为浓硝酸时:Cu电极是 极,其电极反应为 .
(2)请写出用惰性电极电解硫酸铜溶液的总化学方程式 .
(3)燃烧氢气时耗氧量小,放出热量多.已知4g H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为: .
(4)如图2是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出B极发生的电极反应式: .
(5)将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一.已知:
TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140.5kJ/mol
C(s,石墨)+
O2(g)═CO(g)△H=-110.5kJ/mol
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)═TiCl4(l)+2CO(g)的△H是 .

(1)如图1所示,组成一个原电池.
①当电解质溶液为稀硫酸时:Cu电极是
②当电解质溶液为浓硝酸时:Cu电极是
(2)请写出用惰性电极电解硫酸铜溶液的总化学方程式
(3)燃烧氢气时耗氧量小,放出热量多.已知4g H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为:
(4)如图2是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出B极发生的电极反应式:
(5)将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一.已知:
TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140.5kJ/mol
C(s,石墨)+
| 1 |
| 2 |
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)═TiCl4(l)+2CO(g)的△H是
考点:原电池和电解池的工作原理,热化学方程式,用盖斯定律进行有关反应热的计算,电解原理
专题:
分析:(1)①当电解质溶液为稀硫酸时:Fe易失电子作负极、Cu作正极,正极上氢离子得电子生成氢气;
②当电解质溶液为浓硝酸时:铁和浓硝酸发生钝化现象,Cu易失电子作负极、Fe作正极,负极上铜失电子发生氧化反应;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,同时电解质溶液中还生成硫酸;
(3)4g氢气的物质的量是2mol,2mol氢气完全燃烧生成液态水放出571.6kJ,则1mol氢气完全燃烧生成液态水放出285.8kJ热量;
(4)根据图知,B上通入的是氧化剂氧气,所以作正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子;
(5)TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140.5kJ/mol ①
C(s,石墨)+
O2(g)═CO(g)△H=-110.5kJ/mol ②
将方程式①+2②得TiO2(s)+2Cl2(g)+2C(s,石墨)═TiCl4(l)+2CO(g),△H进行相应的改变.
②当电解质溶液为浓硝酸时:铁和浓硝酸发生钝化现象,Cu易失电子作负极、Fe作正极,负极上铜失电子发生氧化反应;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,同时电解质溶液中还生成硫酸;
(3)4g氢气的物质的量是2mol,2mol氢气完全燃烧生成液态水放出571.6kJ,则1mol氢气完全燃烧生成液态水放出285.8kJ热量;
(4)根据图知,B上通入的是氧化剂氧气,所以作正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子;
(5)TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140.5kJ/mol ①
C(s,石墨)+
| 1 |
| 2 |
将方程式①+2②得TiO2(s)+2Cl2(g)+2C(s,石墨)═TiCl4(l)+2CO(g),△H进行相应的改变.
解答:
解:(1)①当电解质溶液为稀硫酸时:Fe易失电子作负极、Cu作正极,正极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,故答案为:正;2H++2e-=H2↑;
②当电解质溶液为浓硝酸时:铁和浓硝酸发生钝化现象,Cu易失电子作负极、Fe作正极,负极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,
故答案为:负;Cu-2e-=Cu2+;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,同时电解质溶液中还生成硫酸,电池反应式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
(3)4g氢气的物质的量是2mol,2mol氢气完全燃烧生成液态水放出571.6kJ,则1mol氢气完全燃烧生成液态水放出285.8kJ热量,其燃烧热化学方程式为 H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol,故答案为:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol;
(4)根据图知,B上通入的是氧化剂氧气,所以作正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-,故答案为:O2+4e-+2CO2=2CO32-;
(5)TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140.5kJ/mol ①
C(s,石墨)+
O2(g)═CO(g)△H=-110.5kJ/mol ②
将方程式①+2②得TiO2(s)+2Cl2(g)+2C(s,石墨)═TiCl4(l)+2CO(g),则△H=(+140.5kJ/mol)+2(-110.5kJ/mol)=-80.5kJ/mol,
故答案为:-80.5kJ/mol.
②当电解质溶液为浓硝酸时:铁和浓硝酸发生钝化现象,Cu易失电子作负极、Fe作正极,负极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,
故答案为:负;Cu-2e-=Cu2+;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,同时电解质溶液中还生成硫酸,电池反应式为2CuSO4+2H2O
| ||
| ||
(3)4g氢气的物质的量是2mol,2mol氢气完全燃烧生成液态水放出571.6kJ,则1mol氢气完全燃烧生成液态水放出285.8kJ热量,其燃烧热化学方程式为 H2(g)+
| 1 |
| 2 |
| 1 |
| 2 |
(4)根据图知,B上通入的是氧化剂氧气,所以作正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-,故答案为:O2+4e-+2CO2=2CO32-;
(5)TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140.5kJ/mol ①
C(s,石墨)+
| 1 |
| 2 |
将方程式①+2②得TiO2(s)+2Cl2(g)+2C(s,石墨)═TiCl4(l)+2CO(g),则△H=(+140.5kJ/mol)+2(-110.5kJ/mol)=-80.5kJ/mol,
故答案为:-80.5kJ/mol.
点评:本题考查原电池和电解池原理、盖斯定律、燃烧热等知识点,侧重考查基本理论,注意不能根据金属的活泼性强弱判断正负极,要根据失电子难易程度判断正负极,为易错点.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
下列说法正确的是( )
| A、向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 |
| B、欲除去Cl2中少量HCl气体,可将此混合气体通过盛饱和食盐水的洗气瓶 |
| C、漂白粉有效成分是CaCl2和Ca(ClO)2,应密闭保存 |
| D、SO2和Cl2都具有漂白作用,所以将两种气体同时作用于潮湿有色物质,可大大增强漂白作用 |
现在市场上洗衣粉多为加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质油渍遇到它,皆能水解而除去,下列衣料中不能用加酶洗衣粉洗涤的是( )
| A、棉织品 | B、毛织品 |
| C、腈纶织品 | D、蚕丝织品 |
下列有关叙述,正确的是( )
| A、加碘食盐能使淀粉溶液变蓝 |
| B、用电石和水反应制乙炔是氧化还原反应 |
| C、1mol乙酸与足量乙醇在浓硫酸催化下加热,可生成1 mol乙酸乙酯 |
| D、利用电石与水反应制取C2H2时,可采用CuSO4溶液除去杂质气体 |
某高分子化合物的部分结构如图,下列说法正确的是( )


| A、若n为聚合度,则该高分子化合物的相对分子质量为97n |
| B、聚合物的链节为─CHCl─CHCl─CHCl─ |
| C、单体为CH2=CHCl |
| D、聚合物的分子式为 CHCl=CHCln |
已知NaHSO4在水中的电离方程式为:NaHSO4═Na++H++SO42-.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.对于该溶液,下列说法不正确的是( )
| A、该温度高于25℃ |
| B、该温度下加入等体积pH=12的氢氧化钠溶液可使反应后的溶液恰好呈中性 |
| C、水电离出的[H+]=10-10 mol?L-1 |
| D、c(H+)═c(OH-)+c(SO42-) |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A、铝跟盐酸反应 |
| B、Ba(OH)2?8H2O和NH4Cl的反应 |
| C、灼热的碳与二氧化碳的反应 |
| D、高温煅烧石灰石 |
25℃时,在含有大量Ba2+的某澄清透明溶液中,由水电离产生的OH-物质的量浓度为1×10-12mol/L,则在此溶液中还一定能够大量共存的离子组是( )
| A、Na+、Cl-、NO3- |
| B、K+、CH3COO-、SO42- |
| C、NH4+、HCO3-、K+ |
| D、Na+、NO3-、Fe3+ |