题目内容
25℃时,在含有大量Ba2+的某澄清透明溶液中,由水电离产生的OH-物质的量浓度为1×10-12mol/L,则在此溶液中还一定能够大量共存的离子组是( )
| A、Na+、Cl-、NO3- |
| B、K+、CH3COO-、SO42- |
| C、NH4+、HCO3-、K+ |
| D、Na+、NO3-、Fe3+ |
考点:离子共存问题
专题:
分析:由水电离产生的OH-物质的量浓度为1×10-12mol/L,该溶液为酸性或碱性溶液,
A.Na+、Cl-、NO3-之间不发生反应,都与不与氢离子、氢氧根离子和钡离子反应;
B.硫酸根离子与钡离子反应生成硫酸钡沉淀、醋酸根离子与氢离子反应生成弱电解质醋酸;
C.碳酸氢根离子既能够与氢离子、也能够与氢氧根离子反应;
D.碱性溶液中,铁离子与氢氧根离子反应生成氢氧化铁沉淀.
A.Na+、Cl-、NO3-之间不发生反应,都与不与氢离子、氢氧根离子和钡离子反应;
B.硫酸根离子与钡离子反应生成硫酸钡沉淀、醋酸根离子与氢离子反应生成弱电解质醋酸;
C.碳酸氢根离子既能够与氢离子、也能够与氢氧根离子反应;
D.碱性溶液中,铁离子与氢氧根离子反应生成氢氧化铁沉淀.
解答:
解:由水电离产生的OH-物质的量浓度为1×10-12mol/L的溶液中存在大量氢离子或氢氧根离子,
A.Na+、Cl-、NO3-之间不反应,且都与不与氢离子、氢氧根离子和Ba2+反应,在溶液中能够大量共存,故A正确;
B.Ba2+、SO42-反应生成硫酸钡沉淀,CH3COO-与氢离子反应生成醋酸,在溶液中不能大量共存,故B错误;
C.HCO3-既能够与氢离子反应,也能够与氢氧根离子反应,在溶液中一定不能大量共存,故C错误;
D.Fe3+与碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选A.
A.Na+、Cl-、NO3-之间不反应,且都与不与氢离子、氢氧根离子和Ba2+反应,在溶液中能够大量共存,故A正确;
B.Ba2+、SO42-反应生成硫酸钡沉淀,CH3COO-与氢离子反应生成醋酸,在溶液中不能大量共存,故B错误;
C.HCO3-既能够与氢离子反应,也能够与氢氧根离子反应,在溶液中一定不能大量共存,故C错误;
D.Fe3+与碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选A.
点评:本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
向某CuSO4饱和溶液中加入含18O的无水CuSO4粉末xg,如温度不变,其结果是( )
| A、无水CuSO4不会溶解,xg粉末质量不变 |
| B、含18O的SO42-进入溶液,白色粉末变成蓝色晶体,其质量大于xg |
| C、含18O的SO42-进入溶液,白色粉末变成蓝色晶体,其质量等于xg |
| D、溶解平衡被破坏,达到新的平衡时有部分含18O的SO42-进入溶液,固体粉末小于xg |
两种浓度不同的NaOH溶液,c(H+)分别为1.0×10-14 mol?L-1和1.0×10-12 mol?L-1,将这两种溶液等体积混合后,所得溶液的c(H+)约为( )
| A、0.5×(10-14+10-12) mol?L-1 |
| B、5×(10-15+10-11) mol?L-1 |
| C、2.0×10-1 mol?L-1 |
| D、2.0×10-14 mol?L-1 |
2008年我国成功举办了奥运会、残奥会,让全世界人们重新认识了中国.北京奥运会期间各种污染物浓度日平均值比去年同期下降50%左右,达到世界发达城市水平,全面兑现了奥运会空气质量承诺,实现了“两个奥运,同样精彩”的目标.我国为改善空气质量而启动的“蓝天工程”得到了全民的支持.下列措施不利于“蓝天工程”建设的是( )
| A、推广使用燃煤脱硫技术,防治SO2污染 |
| B、实施绿化工程,防治扬尘污染 |
| C、研制开发燃料电池汽车,消除机动车尾气污染 |
| D、加大石油、煤炭的开采速度,增加化石燃料的供应量 |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、在标准状况下,2.24 L H2O中含有0.1 NA个水分子 |
| B、0.1mol/LNaCl溶液中含有Na+数为0.1NA |
| C、1molFe与足量盐酸完全反应,Fe失去的电子数为2NA |
| D、在常温下,1molH2含有的原子数一定不是2NA |
关于 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A、其M电子层上的电子为8个 |
| B、该元素位于第三周期第ⅥA族 |
| C、最高正化合价为+2价 |
| D、该元素是长周期元素 |
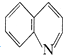 )是一种重要的有机化合物,其合成路线如下:
)是一种重要的有机化合物,其合成路线如下: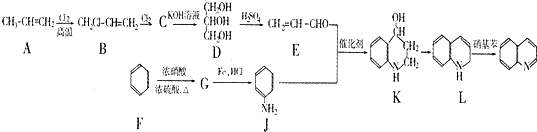
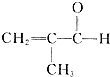 制备物质K的同系物:
制备物质K的同系物: