题目内容
1. 二氧化碳催化加氢合成甲醇的反应:
二氧化碳催化加氢合成甲醇的反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
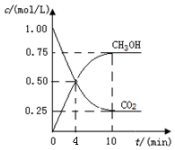
可以用来缓解温室效应、开发新能源.一定条件下,向容积为1L的密闭容器中充入1mol CO2和3mol H2,CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
请回答:
(1)4min内,v(CO2)=0.1875mol/(L•min).
(2)其他条件不变,增大c(CO2),平衡向正(填“正”或“逆”)反应方向移动.
(3)升高温度,该反应的化学平衡常数减小(填“增大”或“减小”).
(4)平衡时,CO2的转化率是75%.
分析 (1)根据v=$\frac{△c}{△t}$计算v(CO2);
(2)增大反应物的浓度,平衡正向移动;
(3)升高温度,平衡向吸热反应方向移动;
(4)转化率=$\frac{浓度变化量}{起始浓度}$×100%.
解答 解:(1)4min 内v(CO2)=$\frac{1mol/L-0.25mol/L}{4min}$=0.1875mol/(L.min),
故答案为:0.1875;
(2)其他条件不变,增大c(CO2),平衡向正反应方向移动,
故答案为:正;
(3)正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,
故答案为:减小;
(4)平衡时,CO2的转化率是$\frac{1mol/L-0.25mol/L}{1mol/L}$×100%=75%,
故答案为:75%.
点评 本题考查化学反应速率与化学平衡计算、化学平衡与平衡常数影响因素,注意化学平衡常数只受温度影响,温度不变,平衡常数不变.

练习册系列答案
相关题目
11.下列离子方程式正确的是( )
| A. | 碳酸钡与盐酸反应 2H++BaCO3=Ba2++H2O+CO2↑ | |
| B. | 氢氧化钡溶液与稀硫酸混合 Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| C. | 氯气通入蒸馏水中 Cl2+H2O=Cl-+ClO-+2 H+ | |
| D. | CO2通入过量的澄清石灰水中 CO2+Ca(OH)2=CaCO3↓+H2O |
12.电解质是一类在水溶液里或熔融状态下能够导电的化合物.下列物质属于电解质的是( )
| A. | Fe | B. | O2 | C. | NaCl | D. | KNO3溶液 |
9.下列有关物质用途的说法中,不正确的是( )
| A. | 铝用于制造电缆 | B. | 硝酸用于制造化肥 | ||
| C. | 常温下用铁制容器盛装浓硫酸 | D. | 四氧化三铁用作红色油漆 |
6.在无色透明酸性溶液中,能共存的离子组是( )
| A. | NH4+、OH-、Al3+、Cl- | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | Mg2+、NO3-、Cl-、Na+ | D. | MnO4-、K+、SO42-、Na+ |
13.下列物质 ①SO2 ②C6H12O6 ③CH3COOH ④NH3 ⑤KNO3 ⑥Cl2 ⑦HNO3⑧CuO ⑨CaCO3 ⑩冰水 不属于电解质的是( )
| A. | ①③④⑥ | B. | ①④⑥⑩ | C. | ①②④⑥ | D. | ①③④⑥ |
10.下列说法正确的是( )
| A. | 胶体区别于其他分散系的本质原因是具有丁达尔效应 | |
| B. | 静电除尘除去空气中的飘尘是利用了胶体粒子的带电性 | |
| C. | 从颜色上无法区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 在江河入海处容易形成沙洲与胶体的聚沉无关 |
11.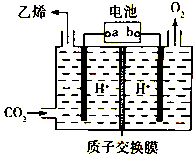 CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )
CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )
 CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )
CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )| A. | a为电池的正极 | |
| B. | 电解过程中H+移向阳极 | |
| C. | 反应前后溶液的pH保持不变 | |
| D. | 阴极反应式:2CO2+12H++12e-=C2H4+4H2O |