题目内容
9.下列有关物质用途的说法中,不正确的是( )| A. | 铝用于制造电缆 | B. | 硝酸用于制造化肥 | ||
| C. | 常温下用铁制容器盛装浓硫酸 | D. | 四氧化三铁用作红色油漆 |
分析 A.铝具有良好的导电性;
B.硝酸与氨气反应生成硝酸铵为氮肥;
C.依据浓硫酸的强氧化性解答;
D.四氧化三铁为黑色固体,三氧化二铁为红棕色固体.
解答 解:A.铝具有良好的导电性,可以用来制造电缆,故A正确;
B.硝酸与氨气反应生成硝酸铵为氮肥,故B正确;
C.浓硫酸具有强的氧化性,常温下能够使铁钝化,所以常温下用铁制容器盛装浓硫酸,故C正确;
D.三氧化二铁为红棕色固体,可用作红色油漆,故D错误;
故选:D.
点评 本题考查了元素化合物知识,侧重考查元素化合物用途,明确相关物质的性质是解题关键,注意对相关知识的积累.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
20.设NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 1molH2O所含有的原子数为NA | |
| B. | 常温常压下,11.2LCl2所含的分子数为0.5NA | |
| C. | 常温常压下,32g O2含有的氧原子数为2NA | |
| D. | 1L0.1mol/LNa2SO4溶液中所含的Na+为0.1NA |
4.下列物质性质的比较中,正确的是( )
| A. | 氧化性:Br2>Cl2 | B. | 稳定性:HF>HCl | ||
| C. | 碱性:Mg(OH)2>NaOH | D. | 酸性:H2SiO3>H2SO4 |
18.下列操作会造成所配溶液的浓度偏低是的( )
| A. | 用烧杯盛氢氧化钠称量 | |
| B. | 浓硫酸溶解后立即转移到容量瓶内 | |
| C. | 用量筒量硫酸时俯视刻度 | |
| D. | 用量筒量硫酸时,倾倒后量筒没有洗涤 |
19.下列化学用语的描述不正确的是( )
| A. | 烧碱的分子式为NaOH | |
| B. | 中子数为15的硅原子:${\;}_{14}^{20}$Si | |
| C. | 乙醇的结构简式:C2H5OH | |
| D. | NH3•H2O的电离方程式:NH3•H2O?NH4++OH- |





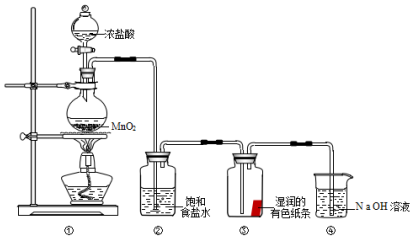
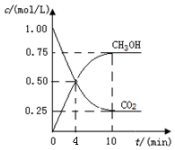 二氧化碳催化加氢合成甲醇的反应:
二氧化碳催化加氢合成甲醇的反应: