题目内容
13.下列物质 ①SO2 ②C6H12O6 ③CH3COOH ④NH3 ⑤KNO3 ⑥Cl2 ⑦HNO3⑧CuO ⑨CaCO3 ⑩冰水 不属于电解质的是( )| A. | ①③④⑥ | B. | ①④⑥⑩ | C. | ①②④⑥ | D. | ①③④⑥ |
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下都不能导电的化合物;例:有机物,非金属氧化物等;
单质与混合物既不是电解质也不是非电解质.
解答 解:①SO2 本身不能电离产生自由移动的离子,是化合物,属于非电解质;
②C6H12O6 在水溶液中和熔融状态下都不能导电的化合物,属于非电解质;
③CH3COOH在水溶液中部分电离,是化合物,属于电解质;
④NH3 本身不能电离产生自由移动的离子,是化合物,属于非电解质;
⑤KNO3 在水溶液中或熔融状态下能导电的化合物,属于电解质;
⑥Cl2 是单质,既不是电解质也不是非电解质;
⑦HNO3在水溶液中能导电的化合物,属于电解质;
⑧CuO熔融状态下能导电,属于电解质;
⑨CaCO3熔融状态下能导电,属于电解质;
⑩冰水是化合物,部分电离,属于弱电解质;
所以:不属于电解质:①②④⑥;
故选:C.
点评 本题考查了电解质、非电解质判断,明确相关概念及物质的类别是解题关键,注意单质与混合物既不是电解质也不是非电解质,题目难度不大.

练习册系列答案
相关题目
3.原子结构、元素周期律和元素周期表对于我们化学学习具有理论指导意义,下列有关说法正确的是( )
| A. | 原子的原子核都是由质子和中子构成的,核外电子在原子核外分层运动 | |
| B. | 可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置 | |
| C. | 由氟氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸 | |
| D. | 在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料 |
4.下列物质性质的比较中,正确的是( )
| A. | 氧化性:Br2>Cl2 | B. | 稳定性:HF>HCl | ||
| C. | 碱性:Mg(OH)2>NaOH | D. | 酸性:H2SiO3>H2SO4 |
8.下列离子方程式正确的是( )
| A. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O | |
| B. | 碳酸氢钠溶液中加盐酸 CO32-+2H+═CO2和H2O | |
| C. | 氢氧化钠溶液中加硫酸镁 2OH-+Mg2+═Mg(OH)2 | |
| D. | 氢氧化钡溶液中加硫酸 OH-+H+═H2O |
18.下列操作会造成所配溶液的浓度偏低是的( )
| A. | 用烧杯盛氢氧化钠称量 | |
| B. | 浓硫酸溶解后立即转移到容量瓶内 | |
| C. | 用量筒量硫酸时俯视刻度 | |
| D. | 用量筒量硫酸时,倾倒后量筒没有洗涤 |
5.现有下列4组物质:
A.H2 I2 O2 Al
B.N2 Fe Cu Zn
C.CaO MgO SO2 CuO
D.HCl NH3 H2SO4 HNO3
A.H2 I2 O2 Al
B.N2 Fe Cu Zn
C.CaO MgO SO2 CuO
D.HCl NH3 H2SO4 HNO3
| A组 | B组 | C组 | D组 | |
| 分类标准 | 非金属单质 | 金属单质 | 金属氧化物 | 酸 |
| 不属于该类的物质 | Al | N2 | SO2 | NH3 |
3.某溶液中含K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-中的若干种,某同学欲探究该溶液的组成,
进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰.
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成.
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色.下列说法正确的是( )
进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰.
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成.
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色.下列说法正确的是( )
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 | |
| C. | 步骤Ⅱ中无色气体是NO气体 | |
| D. | 原溶液中肯定含有K+、Fe2+、NO3-、SO42- |
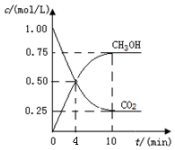 二氧化碳催化加氢合成甲醇的反应:
二氧化碳催化加氢合成甲醇的反应: