题目内容
4.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有HClO | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
分析 溶液中存在平衡Cl2+H2O?HCl+HClO,只有氯气有颜色,为黄绿色,氯水中含有氯气而呈浅黄绿色,溶液中HCl与硝酸银反应产生AgCl白色沉淀,而溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,溶液中氯气、HClO都强氧化性,都可以将亚铁离子氧化为铁离子,而使溶液变为棕黄色.
解答 解:溶液中存在平衡Cl2+H2O?HCl+HClO,
A.只有氯气有颜色,为黄绿色,氯水呈浅黄绿色是由于含有氯气,故A正确;
B.溶液与硝酸银反应产生白色沉淀,只能是氯离子与银离子反应得到AgCl白色沉淀,说明氯水中含有Cl-,故B正确;
C.溶液呈酸性,含有盐酸和次氯酸,次氯酸的酸性比碳酸弱,盐酸与与碳酸氢钠反应生成二氧化碳,故C错误;
D.溶液中氯气、HClO都强氧化性,都可以将亚铁离子氧化为铁离子,而使溶液变为棕黄色,不能说明氯水中含有HClO,故D错误,
故选CD.
点评 本题考查氯水的性质,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,难度不大,侧重对基础知识的考查.

练习册系列答案
相关题目
12.将氯气通入含有大量下列离子的各组溶液中,无现象发生的是( )
| A. | Na+ H+ SO42- | B. | H+ Ag+ NO3- | C. | K+ HCO3-Cl- | D. | Na+ NO3- Fe2+ |
19.在盛有足量A的体积可变的密闭容器中通入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H>0,在一定温度、压强下达到平衡.平衡时C的物质的量与通入B的物质的量的变化关系如图所示.下列说法正确的是:( )

| A. | 平衡时B的转化率为40% | |
| B. | 若再通入B,则再次达平衡时C的体积分数增大 | |
| C. | 在容器中加入催化剂,则B的转化率增大 | |
| D. | 若保持压强一定,当温度升高时,图中θ>45° |
9.下图微粒的结构示意图,正确的是( )
| A. | 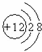 Mg2+ Mg2+ | B. | 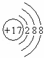 Cl Cl | C. |  Ar Ar | D. | K  |
16.下列有关能量的叙述不正确的是( )
| A. | 活化能的大小对化前后的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因 | |
| C. | 盐酸和NaOH(aq)反应的中和热△H=-57.3kJ.mol-1,则H2S04(aq)和Ba(0H)2(aq)反应的中 和热△H=2×(-57.3 )kJ•mol-1 | |
| D. | 因 N2(g)+3H2(g)?2NHs(g)△H=-dkJ.mol-1,故在某溶器中投入 l molN2与 3molH2充分反应后,放出热量小于dkJ |

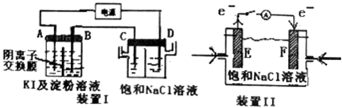 以下装置中,电极材料均为惰性电极.装置Ⅰ中,接通电源,发现A电极附近溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO${\;}_{3}^{-}$+5I-+3H2O.
以下装置中,电极材料均为惰性电极.装置Ⅰ中,接通电源,发现A电极附近溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO${\;}_{3}^{-}$+5I-+3H2O.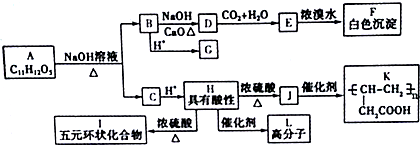
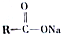 +NaOH$→_{△}^{CuO}$R-H+Na2CO3
+NaOH$→_{△}^{CuO}$R-H+Na2CO3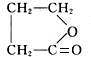 .
.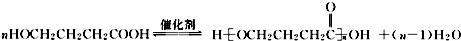 .
.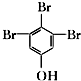 (写结构简式).
(写结构简式).