题目内容
今有如下5个热化学方程式:
H2(g)+
O2(g)=H2O(g)△H=a kJ?mol-1
H2(g)+
O2(g)=H2O(l)△H=b kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=c kJ?mol-1
C(s)+
O2(g)═CO(g)△H=-Q1kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-Q2kJ?mol-1
有关上述反应的叙述错误的是( )
H2(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
2H2(g)+O2(g)=2H2O(l)△H=c kJ?mol-1
C(s)+
| 1 |
| 2 |
C(s)+O2(g)═CO2(g)△H=-Q2kJ?mol-1
有关上述反应的叙述错误的是( )
| A、0<Q1<Q2 | ||
| B、上述反应中反应物总能量均高于生成物总能量 | ||
| C、氢气的标准燃烧热是a kJ?mol-1,碳的标准燃烧热是Q2kJ?mol-1 | ||
D、a>b=
|
考点:反应热的大小比较,燃烧热
专题:
分析:A、一氧化碳燃烧生成二氧化碳需要放出热量;
B、依据热化学方程式分析,反应是放热反应,依据能量守恒分析判断;
C、燃烧热是完全燃烧1mol物质生成最稳定的产物所放出的能量;
D、因水的状态不同,液体变成气态还要吸热,则a>b,又焓变与系数成正比,所以b=
c;
B、依据热化学方程式分析,反应是放热反应,依据能量守恒分析判断;
C、燃烧热是完全燃烧1mol物质生成最稳定的产物所放出的能量;
D、因水的状态不同,液体变成气态还要吸热,则a>b,又焓变与系数成正比,所以b=
| 1 |
| 2 |
解答:
解:A、一氧化碳燃烧生成二氧化碳需要放出热量,所以Q2>Q1>0,故A正确;
B、热化学方程式分析,反应都是放热反应,反应物总能量均高于生成物总能量,故B正确;
C、氢气的燃烧热是完全燃烧1mol氢气单质生成最稳定的产物液体水所放出的能量,所以氢气的燃烧热为bkJ/mol,碳的燃烧热是完全燃烧1mol碳单质生成最稳定的产物二氧化碳所放出的能量,所以碳的燃烧热为-Q2kJ/mol,故C错误;
D、因水的状态不同,液体变成气态还要吸热,则a>b,又焓变与系数成正比,所以b=
c,故D正确;
故选:C;
B、热化学方程式分析,反应都是放热反应,反应物总能量均高于生成物总能量,故B正确;
C、氢气的燃烧热是完全燃烧1mol氢气单质生成最稳定的产物液体水所放出的能量,所以氢气的燃烧热为bkJ/mol,碳的燃烧热是完全燃烧1mol碳单质生成最稳定的产物二氧化碳所放出的能量,所以碳的燃烧热为-Q2kJ/mol,故C错误;
D、因水的状态不同,液体变成气态还要吸热,则a>b,又焓变与系数成正比,所以b=
| 1 |
| 2 |
故选:C;
点评:本题考查燃烧反应的热化学反应方程式,注意物质的状态、化学计量数与反应热的关系即可解答,题目难度不大.

练习册系列答案
相关题目
对下列实验的描述不正确的是( )
A、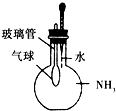 根据气球的变化证明氨气极易溶于水 |
B、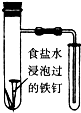 根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
C、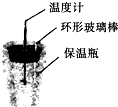 根据温度计读数的变化用稀盐酸和NaOH反应测定中和热 |
D、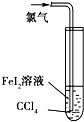 根据试管中液体颜色的变化比较Cl2、Fe3+、I2的氧化性 |
根据下表中有关短周期元素性质的数据,判断下列说法不正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.73 | 1.30 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 0.90 | |
| 主 要 化 合 价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +2 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A、③和⑥、④和⑦分别处于同一主族 |
| B、元素④处于第三周期ⅤA族 |
| C、元素⑧对应的氢氧化物可能具有两性 |
| D、元素①与元素⑥形成的化合物中不可能存在共价键 |
下列离子方程式中正确的是( )
| A、向FeBr2溶液中通入过量氯气:2Fe2++Cl2=2Fe3++2Cl- |
| B、向稀硫酸加入少量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| C、碳酸氢铵溶液与足量的NaOH溶液共热,NH4++OH-?NH3↑+H2O |
| D、鸡蛋壳和醋酸溶液的主要反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
下列为人体提供能量的营养物质中,属于高分子化合物的是( )
| A、蛋白质 | B、油脂 |
| C、葡萄糖 | D、蔗糖 |
下列说法正的是( )
| A、1 mol 蔗糖可水解生成2 mol葡萄糖 |
| B、CH3-CH=CH-CH3与C3H6一定互为同系物 |
| C、C4H9Cl共有同分异构体9种 |
D、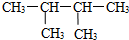 的名称是2,3-二甲基丁烷 的名称是2,3-二甲基丁烷 |
资源利用、环境保护等在与社会可持续发展密切相关的领域发挥着积极作用.下列做法与社会可持续发展理念相违背的是( )
| A、改进汽车尾气净化技术,减少大气污染物的排放 |
| B、过度开采矿物资源,促进地方经济发展 |
| C、开发利用新能源,减少化石燃料的使用 |
| D、加强对工业“三废”的治理,保护环境 |
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表.已知J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )
| J | ||
| R |
| A、J和氢组成的气态氢化物分子中只含有极性共价键 |
| B、M单质能与氢氧化钠溶液反应,产生一种可燃性气体 |
| C、R、T两元素的气态氢化物中,T的气态氢化物更稳定 |
| D、J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4 |