题目内容
4.某课外研究性学习小组拟用粗盐(含有少量杂质包括:泥沙、CaCl2、MgCl2、Na2SO4)经提纯后,配制0.4mol/L 450mL NaCl溶液.他们设计并实施了如下实验,请根据已学过的知识回答下列问题:(1)取一定量的粗盐置于烧杯中加水溶解,所加的水量应为:B(填选项)
A.多加水配成较稀的溶液 B.加入适量的水至能溶解的固体溶解即止
(2)将(1)中配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择①Na2CO3溶液②KOH溶液③AgNO3溶液④NaOH溶液⑤NaHCO3溶液⑥BaCl2溶液,则正确的试剂和加入的顺序应为:CE(填选项)
A.①②③B.②⑥⑤C.④⑥①D.①④⑥E.⑥①④F.⑥②⑤
将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体,请描述在蒸发操作过程中玻璃棒的作用:搅拌,使溶液受热均匀
(3)利用(2)中所得的NaCl固体继续配制所需溶液.在托盘天平上称量11.7g NaCl固体.配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、胶头滴管和500mL容量瓶
(4)配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L的偏差是:(填“偏大”、“偏小”、“无影响”)
①在上述(2)步中没有使用盐酸处理滤液,结果会偏小
②没有对烧杯和玻璃棒进行洗涤,结果会偏小
③定容时俯视凹液面,结果会偏大
④上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线,结果会无影响.
分析 (1)溶解粗盐时,加入的水能使粗盐恰好溶解即可;
(2)根据含有的杂质是CaCl2、MgCl2、Na2SO4,根据既能除去杂质还不能引入新杂质的原则,选择出合适的除杂试剂是:①Na2CO3溶液 ④NaOH溶液 ⑥BaCl2溶液,然后根据①Na2CO3溶液的作用是不但要除去CaCl2,还要除去过量的BaCl2,故①Na2CO3溶液的加入一定要在⑥BaCl2溶液之后,得出所加试剂的顺序;
(3)根据n=cV和m=nM来计算;根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(4)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)溶解粗盐时,加入适量的水能使粗盐恰好溶解即可,故选B;
(2)除去食盐中的CaCl2用①Na2CO3溶液,除去MgCl2用④NaOH溶液,除去Na2SO4用⑥BaCl2溶液,而①Na2CO3溶液的作用是不但要除去CaCl2,还要除去过量的BaCl2,故①Na2CO3溶液的加入一定要在⑥BaCl2溶液之后,故正确的试剂和加入的顺序应为:⑥①④或⑥④①或④⑥①,故选CE;
(3)由于无450mL容量瓶,故需用500mL的容量瓶,配制出500ML的溶液,所需的氯化钠的物质的量n=cV=0.5L×0.4mol/L=0.2mol,质量m=nM=0.2mol×58.5g/mol=11.7g;操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管.
根据提供的仪器可知,还需仪器有500mL容量瓶、胶头滴管,
故答案为:11.7;胶头滴管;500mL容量瓶;
(4)①在上述(2)步骤中没有使用盐酸处理滤液,会导致滤液中有未反应掉的Na2CO3和NaOH,则会导致最终配制溶液中NaCl的浓度相比0.4mol/L的偏小,故答案为:偏小;
②没有对烧杯和玻璃棒进行洗涤,则会导致溶质损失,所配溶液的浓度偏小,故答案为:偏小;
③定容时通过刻线前沿俯视凹液面,会导致溶液体积偏小,则浓度偏大,故答案为:偏大;
④上下颠倒摇匀后液面低于刻度线是正常的,未加水至刻度线是正确的,故对结果无影响,故答案外:无影响.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

①苯燃烧时发生明亮并带有浓烟的火焰
②苯在特定条件下能与氢气发生加成反应
③苯不与酸性高锰酸钾溶液或溴水发生反应
④苯分子具有平面正六边形结构,其中6个碳原子之间的键完全相同.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ① |
| A. | NaHA溶液的pH一定大于7 | |
| B. | 在Na2A,NaHA两种溶液中,离子种类相同 | |
| C. | 在Na2A,NaHA两种溶液中都有c(OH-)+c(A2-)=c(H2A)+c(H+) | |
| D. | 在溶质的物质的量相等的Na2A,NaHA两种溶液中,阴离子总数相等 |
| A. | KClO3是氧化剂 | |
| B. | H2O既不是氧化产物也不是还原产物 | |
| C. | HCl是还原剂 | |
| D. | KCl既是还原产物也是氧化产物 |
| A. | 当溶液中c(H+)>10-7 mol•L-1时,其pH<7,溶液呈现酸性 | |
| B. | 当溶液中c(H+)>10-7 mol•L-1时,其pH>7,溶液呈现碱性 | |
| C. | 当溶液中c(H+)=c(OH-)>10-7 mol•L-1时,其pH<7,溶液呈现中性 | |
| D. | 当溶液中c(H+)=c(OH-)>10-7 mol•L-1时,其pH<7,溶液呈现酸性 |
| A. | 溴水、NaOH溶液 | B. | FeCl3溶液、金属钠 | ||
| C. | 石蕊试液、溴水 | D. | KMnO4酸性溶液、石蕊试液 |
| A. | SiO2是还原剂 | |
| B. | 氧化剂与还原剂的物质的量比为2:1 | |
| C. | 此反应中电子转移4mol | |
| D. | CO是还原产物 |
 ;已知甲为二元弱酸,写出甲在水中电离出一个H+的电离方程式H2O2?H++HO2-.
;已知甲为二元弱酸,写出甲在水中电离出一个H+的电离方程式H2O2?H++HO2-.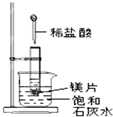 如图所示,把试管放入盛有 25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5mL 盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有 25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5mL 盐酸于试管中,试回答下列问题: