题目内容
5.汽车的启动电源常用铅蓄电池,该电池在放电时的反应为PbO2(s)+Pb(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是( )| A. | PbO2是电池的负极 | |
| B. | 负极的电极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | 铅蓄电池放电时,每转移2mol电子时消耗1mol硫酸 | |
| D. | 电池放电时,两极质量均增加,且每转移1mol电子时正极质量增加48g |
分析 A、蓄电池放电时,该装置是原电池,铅失去电子化合价升高,为电池的负极;
B、电解液为硫酸,铅失去电子生成的二价铅与硫酸根离子结合成硫酸铅;
C、据化学方程式分析,1molPb应转移2mol电子,消耗2mol硫酸;
D、放电时负极铅变为硫酸铅增加硫酸根,正极反应为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,1molPbO2变为PbSO4增加64g,据此计算.
解答 解:A、蓄电池放电时,该装置是原电池,负极上失电子发生氧化反应,该装置中Pb失电子发生氧化反应,所以Pb是负极,故A错误;
B、负极上Pb失电子和硫酸根离子反应生成硫酸铅,即Pb+SO42--2e-=PbSO4,故B正确;
C、1molPb反应转移2mol电子,消耗2mol硫酸,所以当电路中转移2mol电子时,消耗的H2SO4为2 mol,故C错误;
D、放电时两极板质量均增加,负极铅变为硫酸铅增加硫酸根,正极反应为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,每转移1mol电子时增加32g,故D错误;
故选B.
点评 本题考查了二次电池的有关知识,难度不大,注意根据反应方程式判断电解池和原电池,特别是电极反应式的书写,结合电极反应做计算,学习中注意体会书写方法.

练习册系列答案
相关题目
7.下列各组物质中,所含分子数相同的是( )
| A. | 10gH2和10gO2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9gH2O和0.5molBr2 | D. | 22.4mLH2(标准状况)和0.1molN2 |
13.将Cl、Br、I、O、S、C六种化学元素的符号加上“H”,如果元素可以任意组合,原子个数可以任意取用,它们能拼成酸的分子式共有( )
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 多于12种 |
20.向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色.再向反应后的混合物中不断通人 SO2气体,溶液逐渐变成无色.下列分析不正确的是( )
| A. | 滴加KI溶液时,转移2 mol e-时生成 1 mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,不是 SO2的漂白性 | |
| C. | 通入SO2时,SO2与I2反应,I2作氧化剂 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
14.下列说法正确的是( )
| A. | 甲烷与乙烯互为同系物 | |
| B. | 32S与33S是同种核素 | |
| C. | O2与O3互为同位素 | |
| D. | 乙醇和二甲醚(CH3-O-CH3)互为同分异构体 |
15.某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
| A. | Cl-和NH3分子均与Pt4+配位 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | 配合物中中心原子的电荷数和配位数均为6 | |
| D. | 配合物中Cl-与Pt4+配位,而NH3分子不配位 |


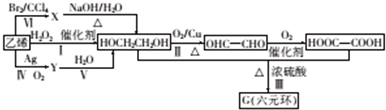
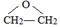 .
. .
.