题目内容
20.向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色.再向反应后的混合物中不断通人 SO2气体,溶液逐渐变成无色.下列分析不正确的是( )| A. | 滴加KI溶液时,转移2 mol e-时生成 1 mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,不是 SO2的漂白性 | |
| C. | 通入SO2时,SO2与I2反应,I2作氧化剂 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
分析 向CuSO4溶液中逐滴加KI溶液至过量,观察到产生白色沉淀CuI,发生2Cu2++4I-=2CuI↓+I2,再向反应后的混合物中不断通人S02气体,溶液逐渐变成无色,发生SO2+I2+2H2O=2HI+H2SO4,结合氧化还原反应来解答.
解答 解:A.滴加KI溶液时,反应为2Cu2++4I-=2CuI↓+I2,转移2mol e-时生成2mol白色沉淀,故A正确;
B.通入SO2后溶液逐渐变成无色,SO2+I2+2H2O=2HI+H2SO4,体现了SO2的还原性,故B错误;
C.通入S02时,S02与I2反应,SO2+I2+2H2O=2HI+H2SO4,I2作氧化剂,故C正确;
D.由反应2Cu2++4I-=2CuI↓+I2、SO2+I2+2H2O=2HI+H2SO4,根据氧化还原反应中氧化剂的氧化性大于氧化产物可知,氧化性为Cu2+>I2>SO2,故D正确;
故选B.
点评 本题考查物质的性质及氧化还原反应,为高频考点,把握发生的氧化还原反应为解答的关键,注意利用信息判断发生的反应及反应中元素的化合价变化,注重基础知识的考查,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
2.下列各组中除去M中混有的杂质N,所使用的试剂及方法正确的是( )
| 选项 | M | N | 除杂试剂 | 除杂方法 |
| A | C2H5OH | H2O | 生石灰 | 蒸馏 |
| B | CH4 | CH2═CH2 | 酸性KMnO4溶液 | 洗气 |
| C | CH3COOCH2CH3 | CH3COOH、C2H5OH | NaOH溶液 | 分液 |
| D | 苯酚 | 三溴苯酚 | 水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
8.如表是A、B、C、D四种有机物的有关信息:
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的结构简式是CH2BrCH2Br.
A与水在一定条件下反应生成C的化学方程式是CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH
(2)A与氢气发生加成反应后生成物质E,E的组成符合通式CnH2n+2.
当n=C时,这类有机物开始出现同分异构体.
A.2 B.3 C.4 D.5
(3)B具有的性质是B.
A.无色无味液体,密度比水大 B.有毒,不溶于水
C.与酸性KMnO4溶液和溴水反应褪色 D.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$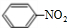 +H2O.
+H2O.
(4)C与D反应生成的产物名称是乙酸乙酯,该反应的反应类型为取代反应或酯化反应.
| A | ①能使溴的四氯化碳溶液褪色; ②填充模型为  ; ;③能与水在一定条件下反应生成C. |
| B | ①由C、H两种元素组成; ②球棍模型为  . . |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成一种有香味的油状物. |
| D | ①由C、H、O三种元素组成; ②球棍模型为  . . |
(1)A与溴的四氯化碳溶液反应的生成物的结构简式是CH2BrCH2Br.
A与水在一定条件下反应生成C的化学方程式是CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH
(2)A与氢气发生加成反应后生成物质E,E的组成符合通式CnH2n+2.
当n=C时,这类有机物开始出现同分异构体.
A.2 B.3 C.4 D.5
(3)B具有的性质是B.
A.无色无味液体,密度比水大 B.有毒,不溶于水
C.与酸性KMnO4溶液和溴水反应褪色 D.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$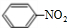 +H2O.
+H2O.(4)C与D反应生成的产物名称是乙酸乙酯,该反应的反应类型为取代反应或酯化反应.
15.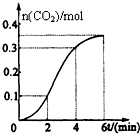 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应2~4分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1mol/(L•min) |
5.汽车的启动电源常用铅蓄电池,该电池在放电时的反应为PbO2(s)+Pb(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是( )
| A. | PbO2是电池的负极 | |
| B. | 负极的电极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | 铅蓄电池放电时,每转移2mol电子时消耗1mol硫酸 | |
| D. | 电池放电时,两极质量均增加,且每转移1mol电子时正极质量增加48g |
10.下列说法正确的是( )
| A. | 将煤干馏可以提高能源的利用率 | |
| B. | 甲烷也是一种温室气体,应禁止使用天然气 | |
| C. | 锌-锰干电池是对环境没任何污染的理想电池 | |
| D. | 寻找高效催化剂,使二氧化硅分解产生硅的同时释放能量 |
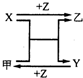 回答下列问题:
回答下列问题: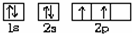 ,乙的电子式为
,乙的电子式为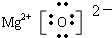 .
.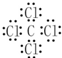 ,乙的化学式为NaCl.
,乙的化学式为NaCl.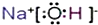 .
.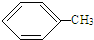 +3HO-NO2$\stackrel{浓硫酸}{→}$
+3HO-NO2$\stackrel{浓硫酸}{→}$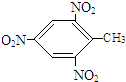 +3H2O.
+3H2O. .
.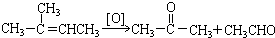
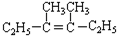 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式 .
.