题目内容
10.X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性:(1)写出实验室制取W2反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)某小组设计如图所示的实验装置(图中夹持和加热装置略去),分别研究YX2、W2的性质.

①分别通入YX2和W2,在装置A中观察到的现象是否相同相同(填“相同”、“不相同”);若装置D中装的是铁粉,当通入W2时D中观察到的现象为产生棕黄色的烟;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学方程式为2SO2+O2$\frac{\underline{\;V_{2}O_{5}\;}}{△}$2SO3.
②若装置B中装入5.0mL1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl.
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量AC(填字母)可以看到白色沉淀生成.
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(4)如由元素Y和X组成-2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入足量氯化钡溶液,有白色沉淀产生,且两种沉淀物质量相等.写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式:S2O32-+Cl2+H2O=SO42-+S↓+2Cl-+2H+.
分析 X、Y和W为原子序数依次增大的短周期元素,X的单质只有氧化性,为氧元素或氟元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,则X只能为O,则Y为S、W为Cl,
(1)实验室通常用二氧化锰与浓盐酸在加热的条件下制备氯气;
(2)①二氧化硫与氯气都可以是品红溶液褪色;氯气与铁反应产生棕黄色的烟;二氧化硫在五氧化二钒作催化剂、加热条件下与氧气反应生成三氧化硫;
②根据电子转移守恒计算I在氧化产物中化合价,确定氧化产物,据此书写方程式;
(3)当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀);
(4)由元素S和O组成-2价酸根Z,Z中Y和X的质量比为4:3,则n(S):n(O)=$\frac{4}{32}$:$\frac{3}{16}$=2:3,则Z为S2O23-,当Cl2与含S2O23-的溶液完全反应后,有浅黄色沉淀产生,说明生成S单质,取上层清液加入氯化钡溶液,有白色沉淀产生,说明生成SO42-,氯气被还有为Cl-,根据守恒配平.
解答 解:X、Y和W为原子序数依次增大的短周期元素,X的单质只有氧化性,为氧元素或氟元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,则X只能为O,则Y为S、W为Cl,
(1)实验室通常用二氧化锰与浓盐酸在加热的条件下制备氯气,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)①二氧化硫与品红化合物无色物质,氯气与水反应生成次氯酸,次氯酸具有强氧化性,将品红氧化为无色物质,二氧化硫与氯气都可以是品红溶液褪色,在装置A中观察到的现象是相同;氯气与铁反应产生棕黄色的烟;二氧化硫在五氧化二钒作催化剂、加热条件下与氧气反应生成三氧化硫,反应方程式为:2SO2+O2$\frac{\underline{\;V_{2}O_{5}\;}}{△}$SO3,
故答案为:相同;产生棕黄色的烟;2SO2+O2$\frac{\underline{\;V_{2}O_{5}\;}}{△}$2SO3;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量Cl2完全反应后,转移的电子为5.0×10-5mol,令碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10-3L×1.0×10-3mol/L×2×a=5.0×10-5mol,解得a=+5,所以碘单质被氧化为HIO3,则该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(3)当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀(或当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀),
故答案为:AC;
(4)由元素S和O组成-2价酸根Z,Z中Y和X的质量比为4:3,则n(S):n(O)=$\frac{4}{32}$:$\frac{3}{16}$=2:3,则Z为S2O23-,当Cl2与含S2O23-的溶液完全反应后,有浅黄色沉淀产生,说明生成S单质,取上层清液加入氯化钡溶液,有白色沉淀产生,说明生成SO42-,氯气被还有为Cl-,反应离子方程式为:S2O32-+Cl2+H2O=SO42-+S↓2Cl-+2H+,
故答案为:S2O32-+Cl2+H2O=SO42-+S↓+2Cl-+2H+.
点评 本题考查元素化合物推断、化学实验、元素化合物性质、常用化学用语、氧化还原反应应用等,(2)中注意根据电子转移守恒计算判断产物,侧重考查学生对知识的综合应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | PbO2是电池的负极 | |
| B. | 负极的电极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | 铅蓄电池放电时,每转移2mol电子时消耗1mol硫酸 | |
| D. | 电池放电时,两极质量均增加,且每转移1mol电子时正极质量增加48g |
| A. | 当液氯罐破损时,为防止液氯泄漏,立即将罐置于碱水池中进行处理 | |
| B. | 不小心将苯酚沾到手上,用酒精洗涤 | |
| C. | 实验桌上酒精灯被碰翻而引起少量酒精着火,用湿布盖灭 | |
| D. | 金属钠着火时,用泡沫灭火器灭火 |
 双氢青蒿素的抗疟疗效是青蒿素的10倍,其结构如图所示,下列说法中错误的是( )
双氢青蒿素的抗疟疗效是青蒿素的10倍,其结构如图所示,下列说法中错误的是( )| A. | 双氢青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素分子中含有过氧链和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
| A. | 乙烯的结构式:C2H4 | B. | 甲烷分子的比例模型: | ||
| C. | 四氯化碳的电子式: | D. | 苯的分子式: |
 ②CH3CH2CH3Br ③CH3Br ④CH3CHBrCH2CH3
②CH3CH2CH3Br ③CH3Br ④CH3CHBrCH2CH3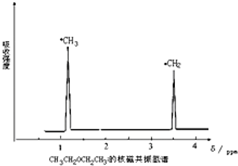 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.例如二乙醚的结构简式为:CH3-CH2-O-CH2-CH3,其核磁共振谱中给出的峰值(信号)有两个,如图所示:
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.例如二乙醚的结构简式为:CH3-CH2-O-CH2-CH3,其核磁共振谱中给出的峰值(信号)有两个,如图所示: