题目内容
15.某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )| A. | Cl-和NH3分子均与Pt4+配位 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | 配合物中中心原子的电荷数和配位数均为6 | |
| D. | 配合物中Cl-与Pt4+配位,而NH3分子不配位 |
分析 实验式为PtCl4•2NH3的物质,其水溶液不导电说明它不是离子化合物,在溶液中不能电离出阴、阳离子.加入AgNO3不产生沉淀,用强碱处理没有NH3放出,说明不存在游离的氯离子和氨分子,所以该物质的配位化学式为[PtCl4(NH3)2].
解答 解:加入AgNO3不产生沉淀,用强碱处理没有NH3放出,说明不存在游离的氯离子和氨分子,所以该物质的配位化学式为[PtCl4(NH3)2],
A.由分析可知,Cl-和NH3分子均与Pt4+配位,形成的配合物为[PtCl4(NH3)2],故A正确;
B.该配合物应是8面体结构,Pt与6个配体成键,故B错误;
C.配合物中中心原子的电荷数电荷数为4,配位数为6,故C错误;
D.用强碱处理没有NH3放出,说明NH3分子配位,故D错误;
故选A.
点评 本题考查配合物的成键情况,题目难度中等,解答本题的关键是能正确把握题给信息,注意明确配合物的形成特点,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.汽车的启动电源常用铅蓄电池,该电池在放电时的反应为PbO2(s)+Pb(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是( )
| A. | PbO2是电池的负极 | |
| B. | 负极的电极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | 铅蓄电池放电时,每转移2mol电子时消耗1mol硫酸 | |
| D. | 电池放电时,两极质量均增加,且每转移1mol电子时正极质量增加48g |
10.下列说法正确的是( )
| A. | 将煤干馏可以提高能源的利用率 | |
| B. | 甲烷也是一种温室气体,应禁止使用天然气 | |
| C. | 锌-锰干电池是对环境没任何污染的理想电池 | |
| D. | 寻找高效催化剂,使二氧化硅分解产生硅的同时释放能量 |
7.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )


| A. | 铜电极上发生反应Cu-2e-=Cu2+ | |
| B. | 工作一段时间后,乙池的c(SO42-)减小 | |
| C. | 电流从铜极经过导线移向锌极 | |
| D. | 电池工作一段时间后,甲池的c(Zn2+)增加 |
4.国外新近研制的溴化锌蓄电池是用溴化锌溶液作电解液,用碳棒作两极.现有四个电极反应:①Zn-2e-═Zn2+②Zn2++2e-═Zn ③2Br--2e-═Br2④Br2+2e-═2Br-,则充电时的阴极和放电时的正极反应分别是( )
| A. | ①③ | B. | ②③ | C. | ④① | D. | ④② |
11.下列实验操作及现象与结论对应关系正确的一组是( )
| 实验操作 | 实验现象 | 实验结论 | |
| A | SO2通入Ba(NO3)2溶液中 | 不产生沉淀 | 亚硫酸的酸性比硝酸弱 |
| B | 气体X通入酸性KMnO4中 | 溶液褪色 | 气体X有漂白性 |
| C | 取少量某无色溶液,先滴加氯水,再加入少量苯,振荡、静置 | 溶液分层,下层呈紫红色 | 原无色溶液中一定有I- |
| D | 将铜片放入稀硝酸中,加热 | 产生大量气体溶液变为蓝色 | 稀硝酸具有强氧化性和酸性 |
| A. | A | B. | B | C. | C | D. | D |
 用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加.
用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加.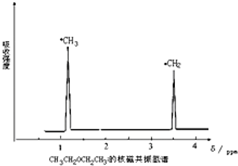 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.例如二乙醚的结构简式为:CH3-CH2-O-CH2-CH3,其核磁共振谱中给出的峰值(信号)有两个,如图所示:
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.例如二乙醚的结构简式为:CH3-CH2-O-CH2-CH3,其核磁共振谱中给出的峰值(信号)有两个,如图所示: