题目内容
如图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出).其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体.M的溶液显浅绿色.
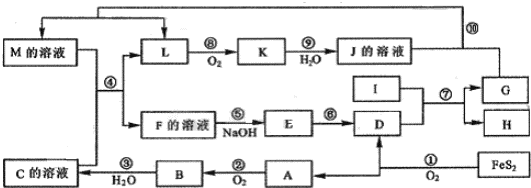
请填写下来空白:
(1)M的化学式 ,I的原子结构示意图 ,在周期表中,在周期表中,组成单质G的元素位于第 周期第 族.
(2)M中阳离子如何检验
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是 (填写序号)
(4)反应④的离子方程式是:
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O.写出该反应的化学方程式并标明电子转移数目和方向:
(6)每生成1mol气态B,反应放出98.3kJ热量,该反应的热化学方程式为 .

请填写下来空白:
(1)M的化学式
(2)M中阳离子如何检验
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是
(4)反应④的离子方程式是:
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O.写出该反应的化学方程式并标明电子转移数目和方向:
(6)每生成1mol气态B,反应放出98.3kJ热量,该反应的热化学方程式为
考点:无机物的推断
专题:
分析:FeS2氧化得到的A可以继续被氧化,则A为SO2,B为SO3,D为Fe2O3,C为B的水化物,则C为H2SO4,I为第三主族熔点最高的金属,则I为Al,反应⑦为铝单质与氧化铁得到Fe与氧化铝,K是一种红棕色气体,则K为NO2,J为HNO3,J与G反应得到L,L被氧化成为NO2,则G为Fe,H为Al2O3,L为NO,联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,F为铁盐溶液,E应为Fe(OH)3,据此解答.
解答:
解:FeS2氧化得到的A可以继续被氧化,则A为SO2,B为SO3,D为Fe2O3,C为B的水化物,则C为H2SO4,I为第三主族熔点最高的金属,则I为Al,反应⑦为铝单质与氧化铁得到Fe与氧化铝,K是一种红棕色气体,则K为NO2,J为HNO3,J与G反应得到L,L被氧化成为NO2,则G为Fe,H为Al2O3,L为NO,联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,F为铁盐溶液,E应为Fe(OH)3,
(1)由以上分析可知,M为Fe(NO3)2,I为Al,原子结构示意图为 ,G为Fe,是26号元素,位于周期表第四周期第Ⅷ族,
,G为Fe,是26号元素,位于周期表第四周期第Ⅷ族,
故答案为:Fe(NO3)2; ;四;Ⅷ;
;四;Ⅷ;
(2)M为Fe(NO3)2,检验含有亚铁离子方法为:取少许溶液于试管中,滴加KSCN溶液无现象,再滴加氯水显红色,则证明有Fe2+,
故答案为:取少许溶液于试管中,滴加KSCN溶液无现象,再滴加氯水显红色,则证明有Fe2+;
(3)在反应②、③、⑥、⑨中,②、⑨都为氧化还原反应,⑥为分解反应,③为SO3+H2O=H2SO4,既属于化合反应又属于非氧化还原反应,故答案为:③;
(4)M中含有Fe2+和NO3-,在酸性条件下可发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(5)化合物Fe2O3与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O,反应方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,标明电子转移数目和方向: ,
,
故答案为: ;
;
(6)每生成1mol气态SO3,反应放出98.3kJ热量,该反应的热化学方程式为:SO2(g)+
O2(g)=SO3(g)△H=-98.3kJ/mol,
故答案为:SO2(g)+
O2(g)=SO3(g)△H=-98.3kJ/mol.
(1)由以上分析可知,M为Fe(NO3)2,I为Al,原子结构示意图为
 ,G为Fe,是26号元素,位于周期表第四周期第Ⅷ族,
,G为Fe,是26号元素,位于周期表第四周期第Ⅷ族,故答案为:Fe(NO3)2;
 ;四;Ⅷ;
;四;Ⅷ;(2)M为Fe(NO3)2,检验含有亚铁离子方法为:取少许溶液于试管中,滴加KSCN溶液无现象,再滴加氯水显红色,则证明有Fe2+,
故答案为:取少许溶液于试管中,滴加KSCN溶液无现象,再滴加氯水显红色,则证明有Fe2+;
(3)在反应②、③、⑥、⑨中,②、⑨都为氧化还原反应,⑥为分解反应,③为SO3+H2O=H2SO4,既属于化合反应又属于非氧化还原反应,故答案为:③;
(4)M中含有Fe2+和NO3-,在酸性条件下可发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(5)化合物Fe2O3与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O,反应方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,标明电子转移数目和方向:
 ,
,故答案为:
 ;
;(6)每生成1mol气态SO3,反应放出98.3kJ热量,该反应的热化学方程式为:SO2(g)+
| 1 |
| 2 |
故答案为:SO2(g)+
| 1 |
| 2 |
点评:本题考查无机物的推断,注意根据FeS2与氧气反应、物质的颜色等为突破口,根据框图寻找线索进行推断,需要学生熟练掌握元素化合物性质,题目难度中等.

练习册系列答案
相关题目
下列变化需要加入还原剂才能实现的( )
| A、KMnO4→Mn2+ |
| B、HCl→Cl2 |
| C、Fe→Fe3+ |
| D、KClO3→O2 |
既能使石蕊试液变红,又能使品红试液变为无色,还能使溴水褪色的是( )
| A、Cl2 |
| B、HCl |
| C、SO2 |
| D、CO2 |
 ]
]
 已知A是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.
已知A是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示. 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白: 认真读书,回归课本,请回答下列问题:
认真读书,回归课本,请回答下列问题: