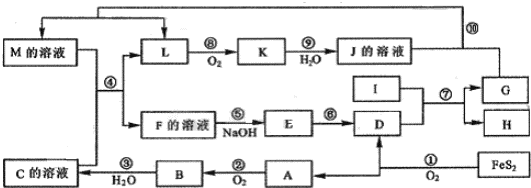
题目内容
 认真读书,回归课本,请回答下列问题:
认真读书,回归课本,请回答下列问题:(1)若废液中存在Ba2+、Cu2+和Ag+这三种离子,某探究小组用NaOH溶液,盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程如图(各步反应恰好完全进行),请回答:
“沉淀1”的化学式:
(2)将金属钠放入CuSO4溶液中会产生蓝色沉淀,为解释这一现象,请写出有关的化学方程式
(3)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰水是提出镁的重要步骤,写出发生反应的离子方程式
(4)电子工作常用30%的FeCl3溶液腐蚀铜箔,制造印刷电路板,此过程发生的离子反应方程式是
考点:常见阳离子的检验
专题:
分析:(1)溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后再加入Na2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,根据物质的性质书写反应的离子方程式.
(2)金属钠放入CuSO4溶液中,钠会先和H2O反应,生成的NaOH再与CuSO4反应;
(3)母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应;
(4)氯化铁与铜反应生成氯化亚铁与氯化铁;检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在;
(2)金属钠放入CuSO4溶液中,钠会先和H2O反应,生成的NaOH再与CuSO4反应;
(3)母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应;
(4)氯化铁与铜反应生成氯化亚铁与氯化铁;检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在;
解答:
解:(1)溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,即试剂A为稀盐酸,沉淀1为AgCl;B试剂应是硫酸钠,故沉淀2为硫酸钡,即硫酸钠与钡离子生成硫酸钡沉淀,反应的离子方程式为:Ba2++SO42-=BaSO4↓;试剂C应是氢氧化钠,氢氧化钠与铜离子生成氢氧化铜沉淀,反应的离子方程式为Cu2++2OH-=Cu(OH)2↓,
故答案为:AgCl;Ba2++SO42-=BaSO4↓;
(2)金属钠放入CuSO4溶液中,钠会先和H2O反应:2Na+2H2O=2NaOH+H2↑,生成的NaOH再与CuSO4反应:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,故答案为:2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(3)母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应,将Mg2+沉淀为Mg(OH)2:Mg2++Ca(OH)2(石灰乳)═Mg(OH)2↓+Ca2+,故答案为:Mg2++Ca(OH)2(石灰乳)═Mg(OH)2↓+Ca2+;
(4)氯化铁与铜反应生成氯化亚铁与氯化铁,反应方程式为:2Fe3++Cu═2Fe2++Cu2+;检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液与试管中,滴加KSCN溶液,发生反应Fe3++3SCN-?Fe(SCN)3,溶液变红,说明Fe3+存在,故答案为:2Fe3++Cu═2Fe2++Cu2+;取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色;
故答案为:AgCl;Ba2++SO42-=BaSO4↓;
(2)金属钠放入CuSO4溶液中,钠会先和H2O反应:2Na+2H2O=2NaOH+H2↑,生成的NaOH再与CuSO4反应:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,故答案为:2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(3)母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应,将Mg2+沉淀为Mg(OH)2:Mg2++Ca(OH)2(石灰乳)═Mg(OH)2↓+Ca2+,故答案为:Mg2++Ca(OH)2(石灰乳)═Mg(OH)2↓+Ca2+;
(4)氯化铁与铜反应生成氯化亚铁与氯化铁,反应方程式为:2Fe3++Cu═2Fe2++Cu2+;检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液与试管中,滴加KSCN溶液,发生反应Fe3++3SCN-?Fe(SCN)3,溶液变红,说明Fe3+存在,故答案为:2Fe3++Cu═2Fe2++Cu2+;取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色;
点评:本题考查化学工艺流程、根据方程的计算、元素化合物性质等,掌握元素化合物的性质、混合物的分离、提纯方法是解决本题的关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法中正确的是( )
| A、互为手性异构体的分子互为镜像,且分子组成相同,性质也相同 |
| B、由酸性FCH2COOH>CH3COOH,可知酸性ClCH2COOH>CH3COOH |
| C、由AgCl和AgBr都能溶于氨水中,而AgI不能溶解在氨水中,可知AgI在水中的溶解度更大 |
| D、除HF外,其他卤化氢沸点随相对分子质量增大而升高,是因为氢键的键能逐渐增大所致 |
某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度,有关叙述正确的是( )
| A、H2Y在电离时:H2Y+H2O?HY-+H3O+ |
| B、在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+) |
| C、在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) |
| D、HY-水解方程式为:HY-+H2O?Y2-+H3O+ |
实验室用MnO2和浓盐酸来制取氯气,主要操作有:①将蒸馏烧瓶固定在铁架台上;②把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定好铁圈,放好石棉网;③用药匙向蒸馏烧瓶中加入MnO2,再向分液漏斗中加浓盐酸,并将导管放入集气瓶中;④检查气密性;⑤在蒸馏烧瓶上装好分液漏斗,连接好导管.最好的实验操作顺序是( )
| A、②③④①⑤ |
| B、②①③⑤④ |
| C、②①⑤④③ |
| D、②①③④⑤ |
容量瓶上必须标明( )
①温度 ②浓度 ③容量 ④压强 ⑤刻度线.
①温度 ②浓度 ③容量 ④压强 ⑤刻度线.
| A、②③④ | B、①③⑤ | C、③④ | D、③ |