题目内容
4.影响化学反应速率的因素很多,下列措施一定能提高反应速率的是( )| A. | 改变反应物用量 | B. | 增大压强 | C. | 增大体积 | D. | 升高温度 |
分析 一般来说,升高温度、增大浓度、加入催化剂以及增大反应气体的压强,可增大反应速率,注意增大压强时,反应物的浓度增大,反应速率才能增大,以此解答.
解答 解:A.增大反应物浓度,反应速率加快,若反应物为纯固体或纯液体,改变其用量,反应速率不变,故A不选;
B.对气体参加的反应,增大压强,反应速率增大,而对无气体参加的反应,减小压强反应速率不变,故B不选;
C.如为固体或溶液中的反应,增大体积,浓度不变,反应速率不变,故C不选;
D.升高温度,活化分子的百分数增大,反应速率增大,故D选.
故选D.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的理解和运用的考查,注意相关基础知识的积累,把握影响反应速率的因素和影响原因,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
17.在强酸性或强碱性溶液中都能大量共存的一组离子是( )
| A. | Ba2+、Fe3+、Br-、NO3- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Al3+、NH4+、SO42-、Na+ | D. | Na+、K+、NO3-、SO42- |
14.对于反应4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g),改变下列条件不会影响反应速率的是( )
| A. | 增大压强 | B. | 不断鼓入空气 | C. | 加入FeS2 | D. | 升高温度 |
1.下表是元素周期表的一部分,针对表中的①-⑧种元素,填写下列空白;
(1)上述元素中,形成化合物种类最多的是C(填元素符号);
(2)元素①的非金属性比元素⑥强,可以用来证明该结论的事实是:碳酸的酸性比硅酸的酸性强;
(3)元素②的气态氢化物与⑧的单质发生置换反应的方程式为2NH3+Cl2=N2+6HCl;
(4)元素③和④形成的化合物中可以做供氧剂、漂白剂的是Na2O2(填化学式);
(5)元素③、⑤和⑦形成的化合物常用于工业污水的处理,其主要作用为铝离子水解生成胶体具有吸附性,可净化水.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)元素①的非金属性比元素⑥强,可以用来证明该结论的事实是:碳酸的酸性比硅酸的酸性强;
(3)元素②的气态氢化物与⑧的单质发生置换反应的方程式为2NH3+Cl2=N2+6HCl;
(4)元素③和④形成的化合物中可以做供氧剂、漂白剂的是Na2O2(填化学式);
(5)元素③、⑤和⑦形成的化合物常用于工业污水的处理,其主要作用为铝离子水解生成胶体具有吸附性,可净化水.
9.下列化合物分子中的所有原子都处于同一平面的是( )
| A. | 甲烷 | B. | 对二甲苯 | C. | 氯乙烯 | D. | 丙烯 |
14. 某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.
某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.
(1)CO的检测.
①粉红色的PdCl2溶液可以检验空气中少量的CO.若空气中含CO,则溶液中会产生黑色的Pd沉淀,每生成5.3gPd沉淀,反应转移电子数为0.1NA.
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图1所示,这种传感器利用了燃料电池原理.则该电池的负极反应式为CO+H2O-2e-=CO2+2H+.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如表:
①上述反应T1℃时的平衡常数为K=$\frac{9}{16}$.
②根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,反应原理为NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O,△<0在氨气足量的情况下,不同$\frac{c(N{O}_{2})}{c(NO)}$、不同温度对脱氨率的影响如图2所示.请回答温度对脱氨率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小;300℃之前,反应未平衡,反应向右进行,脱氮率增大,给出合理的解释300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小.
(4)硫酸厂尾气中的SO2可催化氧化生成SO3,再合成硫酸.在某温度时,向10L的密闭容器中加入4.0molSO2和10.0molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是BC(填序号)
A.在其他条件不变时,减少容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍.
 某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.
某城市实时空气质量检测报告中标明空气中包含多种气体污染物,如CO、氮氧化物(NOx)、SO2等.(1)CO的检测.
①粉红色的PdCl2溶液可以检验空气中少量的CO.若空气中含CO,则溶液中会产生黑色的Pd沉淀,每生成5.3gPd沉淀,反应转移电子数为0.1NA.
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图1所示,这种传感器利用了燃料电池原理.则该电池的负极反应式为CO+H2O-2e-=CO2+2H+.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如表:
 | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,反应原理为NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O,△<0在氨气足量的情况下,不同$\frac{c(N{O}_{2})}{c(NO)}$、不同温度对脱氨率的影响如图2所示.请回答温度对脱氨率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小;300℃之前,反应未平衡,反应向右进行,脱氮率增大,给出合理的解释300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小.
(4)硫酸厂尾气中的SO2可催化氧化生成SO3,再合成硫酸.在某温度时,向10L的密闭容器中加入4.0molSO2和10.0molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是BC(填序号)
A.在其他条件不变时,减少容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍.
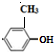
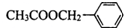 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: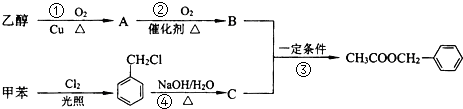
 +H2O$→_{△}^{氢氧化钠}$
+H2O$→_{△}^{氢氧化钠}$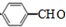 ;试写出遇FeCl3溶液显紫色,且符合以下条件的C的同分异构体的结构简式:
;试写出遇FeCl3溶液显紫色,且符合以下条件的C的同分异构体的结构简式: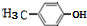
 .
.
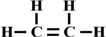 ,空间结构是平面型分子;
,空间结构是平面型分子;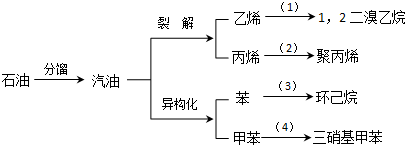
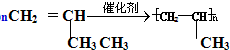 (加成聚合反应)
(加成聚合反应)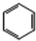 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$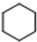 (加成反应)
(加成反应)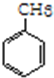 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$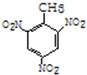 +3H2O(取代反应)
+3H2O(取代反应) .
. .
. (不考虑顺反异构).
(不考虑顺反异构).