题目内容
7.下列实验操作或装置符合实验要求的是( )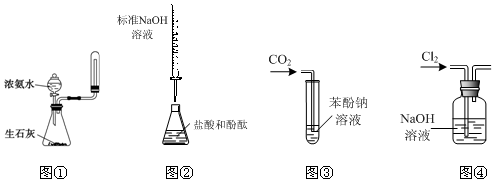
| A. | 实验室利用图①装置制取并收集氨气 | |
| B. | 利用图②装置测定盐酸的浓度 | |
| C. | 利用装置③验证碳酸的酸性强于苯酚 | |
| D. | 利用图④装置除去Cl2中的氯化氢 |
分析 A.收集氨气的试管口不能密封;
B.NaOH用碱式滴定管盛放;
C.发生强酸制取弱酸的反应,可知碳酸的酸性大于硅酸的酸性;
D.二者均与NaOH溶液反应.
解答 解:A.收集氨气的试管口不能密封,否则气体过多试管易炸裂,故A错误;
B.NaOH用碱式滴定管盛放,图中为酸式滴定管,故B错误;
C.发生强酸制取弱酸的反应,观察到白色沉淀,沉淀为硅酸,则可验证碳酸的酸性强于苯酚,故C正确;
D.二者均与NaOH溶液反应,不能除杂,应选饱和食盐水,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、气体的制备实验、中和滴定、混合物分离提纯等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
19.民以食为天,食品安全越来越受到大家的关注.下列有关说法正确的是( )
| A. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| B. | 镉元素属于重金属元素,食用‘镉大米’会影响骨骼和肾脏 | |
| C. | 使用增塑剂--邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)中阴、阳离子的个数之比为2:1 |
18.哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖.现向一恒压密闭容器中充入1mol N2和3mol H2,在一定条件下发生反应N2+3H2?2NH3.下列有关说法正确的是( )
| A. | N2完全转化为NH3时,即可视为达到化学平衡状态 | |
| B. | 达到化学平衡时,容器内压强和气体密度都不再变化 | |
| C. | 达到化学平衡时,反应则停止进行 | |
| D. | 达到化学平衡时,3ν(逆NH3)=2ν(正H2) |
15. 异戊烯醇用于苯氯菊酯杀虫剂以及其他精细化学品的合成,是生产医药或农药的重要原
异戊烯醇用于苯氯菊酯杀虫剂以及其他精细化学品的合成,是生产医药或农药的重要原
料,其结构如图,下列关于异戊烯醇的说法错误的是( )
 异戊烯醇用于苯氯菊酯杀虫剂以及其他精细化学品的合成,是生产医药或农药的重要原
异戊烯醇用于苯氯菊酯杀虫剂以及其他精细化学品的合成,是生产医药或农药的重要原料,其结构如图,下列关于异戊烯醇的说法错误的是( )
| A. | 分子式为C5H10O | |
| B. | 与氢气发生加成反应后生成物名称为2-甲基-丁醇 | |
| C. | 可使酸性KMnO4溶液褪色 | |
| D. | 与 互为同分异构体 互为同分异构体 |
2.下列指定反应的离子方程式正确的是( )
| A. | BaSO3与稀HNO3反应:BaSO3+2H+═Ba2++SO2↑+H2O | |
| B. | Ca(OH)2溶液与过量NaHCO3溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
12. 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )| A. | 该反应的化学方程式为3X+Y?2Z | |
| B. | 容器内混合气体的平均摩尔质量保持不变表明该反应一定达到平衡状态 | |
| C. | 平衡时,体系的压强是开始时的1.8倍 | |
| D. | 平衡时,Y的体积分数为50% |
19.下列方法用于快速、微量、精确测定有机物相对分子质量的是( )
| A. | 元素分析 | B. | 红外光谱 | C. | 质谱 | D. | 核磁共振氢谱 |
16.下列物质中,属于非电解质的是( )
| A. | 铜丝 | B. | 氯化钠 | C. | 浓硫酸 | D. | 乙醇 |
17.下列反应的离子方程式正确的是( )
| A. | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| B. | 向含1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时的反应:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 向Fe(NO3)2和NaBr混合溶液中滴加少量的稀盐酸:6Br-+2NO3-+8H+=3Br2+2NO↑+4H2O |