题目内容
20.氰化钠(NaCN)氰化钠是一种重要的基本化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金银等贵重金属提炼和电镀.(1)工业上用常温下两种固体单质和一种气态氢化物来生产氰化钠同时生产一种气体单质,请写出其化学方程式为2Na+2C+2NH3=2NaCN+3H2
该反应中的氧化产物为NaCN;每生产1molNaCN转移电子数为3mol
(2)氰化钠溶液在碱性环境中能被氯气氧化生产两种无毒气体,这两种无毒的气体分别是CO2和N2(填化学式)
(3)氰[(CN)2]、硫氰[(SCN)2]的化学性质和卤素很相似,化学上称为拟卤素,氧化性大小:Cl2>Br2>(CN)2>(SCN)2>I2.试写出:
①(SCN)2与KOH溶液反应的化学方程式(SCN)2+2KOH═KSCN+KSCNO+H2O
②NaBr和KI的混合溶液中加入(CN) 2,反应的离子方程式:(CN)2+2I-═2CN-+I2.
分析 (1)钠、碳和氨气反应生成氰化钠和氢气,其中Na元素化合价由0价升高到+1价,C元素化合价由0价升高到+2价,据此分析计算;
(2)氰化钠溶液在碱性环境中能被氯气氧化生产两种无毒气体即氮气和二氧化碳;
(3)①根据氯气与KOH溶液的反应,类推(CN)2与KOH溶液的反应;
②氧化性大小:Cl2>Br2>(CN)2>(SCN)2>I2,则阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-,NaBr和KI的混合溶液中加入(CN) 2,只发生KI与(CN)2的反应.
解答 解:(1)钠、碳和氨气反应生成氰化钠和氢气,化学方程式为2Na+2C+2NH3=2NaCN+3H2,其中Na元素化合价由0价升高到+1价,C元素化合价由0价升高到+2价,则生成NaCN为氧化产物,每生产1molNaCN转移电子数为1mol×(2-0)+1mol×(1-0)=3mol,故答案为:2Na+2C+2NH3=2NaCN+3H2;NaCN;3;
(2)氰化钠溶液在碱性环境中能被氯气氧化生产两种无毒气体,则C生成CO2,N生成N2,故答案为:CO2和N2;
(3)①由Cl2+2KOH=KCl+KClO+H2O可知,(SCN)2的化学性质和卤素很相似,则(SCN)2与KOH(aq)反应的化学方程式为(SCN)2+2KOH═KSCN+KSCNO+H2O,故答案为:(SCN)2+2KOH═KSCN+KSCNO+H2O;
②氧化性大小:Cl2>Br2>(CN)2>(SCN)2>I2,则阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-,NaBr和KI的混合溶液中加入(CN) 2,只发生KI与(CN)2的反应,该反应为(CN) 2+2 I-═2CN-+I2,
故答案为:(CN) 2+2 I-═2CN-+I2.
点评 本题以拟卤素及其化合物为载体考查氧化还原反应、物质制备等知识点,为高频考点,明确氧化还原反应特点、物质性质即可解答,题目难度中等.

| A. | 分液漏斗使用前需要先检查是否漏液 | |
| B. | 试验中剩余的钠不能再放回原试剂瓶 | |
| C. | 做焰色反应时,铂丝应用盐酸洗净并灼烧至无色 | |
| D. | 蒸馏烧瓶加热时需要垫石棉网 |
| A. | 将少量铜屑溶解在浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 用氢氧化钠溶液吸收氯气:Cl2+2OH-═ClO-+H2O | |
| C. | 用足量氨水吸收二氧化硫:2OH-+SO2═SO42-+H2O | |
| D. | 将稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ |
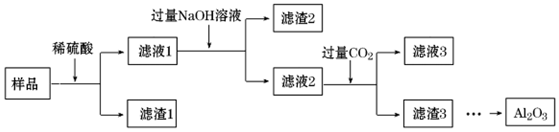
| A. | 滤渣1 的主要成分为SiO2 | |
| B. | 可用KSCN溶液检验滤液1中的Fe 3+ | |
| C. | 滤液2为纯净的Na AlO2溶液 | |
| D. | 将滤渣3 洗涤、干燥、灼烧,可以得到Al2O3 |
①Na和O2②S和O2③Al和NaOH④CO2和Ca(OH)2 ⑤Cu和HNO3⑥Fe和C12⑦Na2CO3和HCl.
| A. | 全部 | B. | 除②、③、⑥外 | C. | 除②、④、⑦外 | D. | 除③、⑥、⑦外 |
| A. | 同压强、同体积的N2O和CO2 | B. | 同体积、同密度的C2H4和C3H6 | ||
| C. | 同温度、同体积的H2和N2 | D. | 同体积、不同密度的N2和CO |
| A. | 由方程式①可知,H2O2的氧化性比Fe3+强 | |
| B. | 在H2O2分解过程中,溶液的H+的物质的量逐渐上升 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
| A. | Na→NaOH→Na2CO3→NaCl | B. | Mg→MgCl2→Mg(OH)2→MgO | ||
| C. | Al→Al2O3→Al(OH)3→AlCl3 | D. | Cl2→Ca(ClO)2→HClO→HCl |
 图中表示A~E五种物质的转化关系.若将它们灼烧,火焰都呈黄色;A能跟水起剧烈反应,D常用作潜水艇里的氧气来源.试推断A~E各物质(写化学式):
图中表示A~E五种物质的转化关系.若将它们灼烧,火焰都呈黄色;A能跟水起剧烈反应,D常用作潜水艇里的氧气来源.试推断A~E各物质(写化学式):